Amenorgamientu-oxidación
Denominar reaición d'amenorgamientu-oxidación, de óxido-reducción o, a cencielles, reaición redox, a toa reaición química na qu'unu o más electrones tresferir ente los reactivos, provocando un cambéu nos sos estáu d'oxidación.[1]
| Amenorgamientu-oxidación | |
|---|---|
|
Reacción química y Q2576859 | |
 | |
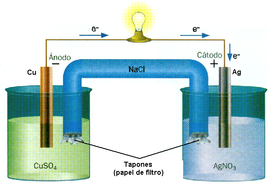

Por que esista una reaición d'amenorgamientu-oxidación, nel sistema tien d'haber un elementu que venza electrones, y otru que los acepte:
- L'axente oxidante ye aquel elementu químicu que tiende a captar esos electrones, quedando con un estáu d'oxidación inferior al que tenía, esto ye, siendo amenorgáu.
- L'axente reductor ye aquel elementu químicu que suministra electrones de la so estructura química al mediu, aumentando'l so estáu d'oxidación, ye dicir siendo ferruñosu.[2]
Cuando un elementu químicu reductor dexa electrones al mediu, convertir nun elementu ferruñosu, y la rellación que guarda col so precursor queda establecida por aciu lo que se llama un par redox». Análogamente, dizse que, cuando un elementu químicu capta electrones del mediu, esti convertir nun elementu amenorgáu, ya igualmente forma un par redox col so precursor ferruñosu. Cuando una especie puede aferruñase, y al empar amenorgase, denominar anfolito, y al procesu de la oxidación-amenorgamientu d'esta especie llámase-y anfolización.
Principiu de electroneutralidad
editarEl principiu de electroneutralidad de Pauling correspuende a un métodu d'aproximamientu pa envalorar la carga en molécules o iones complexos; esti principiu supón que la carga siempres se distribúi en valores cercanos a 0 (esto ye, -1, 0, +1).
Dientro d'una reaición global redox, dase una serie de reaiciones particulares llamaes semirreaiciones o reaiciones parciales.
- Semirreaición d'amenorgamientu:
- Semirreaición d'oxidación:
o más comúnmente, tamién llamada ecuación xeneral:
L'enclín a amenorgar o aferruñar a otros elementos químicos se cuantifica por aciu el potencial d'amenorgamientu, tamién llamáu potencial redox.
Una titulación redox ye aquella na qu'un indicador químicu indica'l cambéu nel porcentaxe de la reaición redox por aciu el viraje de color ente l'oxidante y el reductor.
Oxidación
editarLa oxidación ye una reaición química onde un elementu vence electrones, y polo tanto aumenta'l so estáu d'oxidación.[3]
Tien de tenese en cuenta qu'en realidá una oxidación o un amenorgamientu ye un procesu pol cual camuda l'estáu d'oxidación d'un compuestu. Esti cambéu nun significa necesariamente un intercambiu d'iones. Implica que tolos compuestos formaos por aciu un procesu redox son iónicos, yá que ye nestos compuestos onde sigo se da un enllaz iónicu, productu de la tresferencia d'electrones.
Por casu, na reaición de formación del cloruru d'hidróxenu a partir de los gases dihidrógeno y dicloro, dase un procesu redox y sicasí fórmase un compuestu covalente.
Estos dos reaiciones siempres se dan xuntes; esto ye, cuando una sustancia aferrúñase, siempres ye pola aición d'otra que s'amenorga. Una dexa electrones y la otra aceptar. Por esta razón, prefierse'l términu xeneral de reaiciones redox.
La vida mesma ye un fenómenu redox. El osíxenu ye'l meyor oxidante qu'esiste por cuenta de que la molécula ye pocu reactiva (pol so doble enllaz), y sicasí ye bien electronegativu, cuasi tanto como'l flúor.
La sustancia más oxidante qu'esiste ye'l catión KrF+
porque fácilmente forma Kr y F+
.
Ente otres, esisten el permanganato de potasiu (KMnO
4), l'dicromato de potasiu (K
2Cr
2O
7), l'agua osixenada (H
2O
2), l'acedu nítrico (HNO
3), los hipohalitos y los halatos (por casu l'hipoclorito de sodiu (NaClO) bien oxidante en mediu alcalín y el bromato de potasiu (KBrO
3)). L'ozonu (O
3) ye un oxidante bien enérxicu:
El nome de "oxidación" provién de que, na mayoría d'estes reaiciones, la tresferencia d'electrones dar por aciu l'adquisición d'átomos d'osíxenu (cesión d'electrones) o viceversa. Sicasí, la oxidación y l'amenorgamientu puede dase ensin qu'haya intercambiu d'osíxenu pel mediu: por casu, la oxidación de yoduro de sodiu a yodu por aciu l'amenorgamientu de cloru a cloruru de sodiu:
Ésta puede desglosarse nos sos dos semirreaiciones correspondientes:
- Semirreaición d'amenorgamientu:
- Semirreaición d'oxidación:
- Exemplu El
fierro puede presentar dos formes ferruñoses:
- Óxidu de fierro (II): FEU.
- Óxidu de fierro (III): Fe
2O
3.
Amenorgamientu
editarEn química, amenorgamientu ye'l procesu electroquímicu pol cual un átomu o un ion gana electrones. Implica l'amenorgamientu del so estáu d'oxidación. Esti procesu ye contrariu al d'oxidación.
Cuando un ion o un átomu amenórgase presenta estes carauterístiques:
- Actúa como axente oxidante.
- Ye amenorgáu por un axente reductor.
- Mengua'l so estáu o númberu d'oxidación.
- Exemplu El
ion fierro (III) pue ser amenorgáu a fierro (II):
En química orgánica, l'amenorgamientu d'enllaces d'átomos d'osíxenu a átomos de carbonu o l'aumentu d'enllaces d'hidróxenu a átomos de carbonu interprétase como una amenorgamientu. Por casu:
Númberu d'oxidación
editarLa cuantificación d'un elementu químicu puede efectuase por aciu el so númberu d'oxidación. Mientres el procesu d'oxidación, el númberu d'oxidación o tamién llamáu estáu d'oxidación del elementu aumenta. Sicasí, mientres l'amenorgamientu, el númberu d'oxidación de la especie que s'amenorga mengua. El númberu d'oxidación ye un númberu enteru que representa'l númberu d'electrones qu'un átomu pon en xuegu cuando forma un enllaz determináu. Nun elementu puru tolos átomos son neutros, una y bones estos nun tien carga y asígnase-y l'estáu d'oxidación 0.
El númberu d'oxidación:
- Aumenta si'l átomu pierdi electrones (l'elementu químicu que s'aferruña), o los comparte con un átomu que tenga enclín a captalos.
- Mengua cuando'l átomu gana electrones (l'elementu químicu que s'amenorga), o los comparte con un átomu que tenga enclín a vencelos.
Regles p'asignar el númberu d'oxidación
editar- El númberu d'oxidación de tolos elementos ensin combinar ye cero. Independientemente de la forma en que se representen.
- El númberu d'oxidación de les especies ióniques monoatómicas coincide cola carga del ion.
- El númberu d'oxidación del hidróxenu combináu ye +1, sacante nos hidruros metálicos, onde'l so númberu d'oxidación ye –1 (ej: AlH
3, LiH). - El númberu d'oxidación del osíxenu combináu ye –2, sacante nos peróxidos, onde'l so númberu d'oxidación ye –1 (ej.:Na
2O
2, H
2O
2). - El númberu d'oxidación nos elementos metálicos, cuando tán combinaos ye siempres positivu y numbéricamente igual a la carga del ion.
- El númberu d'oxidación de los halóxenos nos hidrácidos y los sos respeutivos sales ye –1, sicasí'l númberu d'oxidación del azufre nel so hidrácido y respeutivos sales ye –2.
- El númberu d'oxidación d'una molécula neutra ye cero, polo cual la suma de los númberos d'oxidación de los átomos que constitúin a una molécula neutra ye cero.
- La carga llétrica total d'una molécula non-neutra (non nula) corresponder cola suma alxebraica de los númberos d'oxidación de toles especies atómiques que la constitúin. ( ej: MnO−
4 = (1)*(+7) + (4)*(-2) = -1).
Axuste d'ecuaciones
editarTou procesu redox rique del axuste estequiométrico de los componentes de les semirreaiciones pa la oxidación y amenorgamientu.
Pa reaiciones en mediu aguacientu, xeneralmente añader:
- en mediu acedu iones hidrógeno (H+
), molécules d'agua (H
2O), y electrones - en mediu básicu hidroxilos (OH−
), molécules d'agua (H
2O), y electrones pa compensar los cambeos nos númberos d'oxidación.
Mediu ácidu
editarEn mediu ácidu amiéstense hidronios (cationes) (H+
) y agua (H
2O) a les semirreaiciones pa banciar la ecuación final.
Del llau de la ecuación que faiga falta osíxenu van amestase molécules d'agua, y del llau de la ecuación que faigan falta hidróxenos van amestase hidronios.
Por casu, cuando'l Manganesu (II) reacciona col Bismutato de Sodiu.
Ecuación ensin banciar:
- Oxidación :
- Amenorgamientu :
Agora tenemos qu'amestar los hidronios y les molécules d'agua onde faiga falta hidróxenos y onde faiga falta osíxenos, respeutivamente.
- Oxidación:
- Amenorgamientu:
Les reaiciones van banciar al momentu d'igualar la cantidá d'electrones qu'intervienen en dambes semirreaiciones. Esto llograráse multiplicando la reaición d'una semirreación pol númberu d'electrones de la otra semirreaición (y, de ser necesariu, viceversa), de cuenta que la cantidá d'electrones seya constante.
- Oxidación:
- Amenorgamientu:
A la fin vamos tener:
- Oxidación:
- Amenorgamientu:
Como puede vese, los electrones tán banciaos, asina que damos en sumar los dos semirreaiciones, pa llograr finalmente la ecuación banciada.
Mediu básicu
editarEn mediu básicu amiéstense iones hidróxidos (aniones) (OH−
) y agua (H
2O) a les semirreaiciones pa banciar la ecuación final.
Por casu, tenemos la reaición ente'l Permanganato de Potasiu y el Sulfito de Sodiu.
Ecuación ensin banciar:
Dixebramos les semirreaiciones en
- Oxidación:
- Amenorgamientu:
Amestamos la cantidá fayadiza d'Hidróxidos y Agua (les molécules d'agua asítiense onde hai mayor cantidá d'osíxenos).
- Oxidación:
- Amenorgamientu:
Banciamos la cantidá d'electrones al igual que nel exemplu anterior.
- Oxidación:
- Amenorgamientu:
Llogramos:
- Oxidación:
- Amenorgamientu:
Como puede vese, los electrones tán banciaos, asina que damos en sumar los dos semirreaiciones, pa llograr finalmente la ecuación banciada.
Aplicaciones
editarNa industria, los procesos redox tamién son bien importantes, tantu pol so usu granible (por casu l'amenorgamientu de minerales pal llogru del aluminiu o del fierro) como pola so prevención (por casu nel escomiu).
La reaición inversa de la reaición redox (que produz enerxía) ye la electrólisis, na cual apúrrese enerxía pa disociar elementos de los sos molécules.
Oxidaciones y amenorgamientos biolóxicos
editarNel metabolismu de tolos seres vivos, los procesos redox tienen una importancia capital, yá que tán arreyaos na cadena de reaiciones químiques de la fotosíntesis y de la respiración aeróbica. En dambes reaiciones esiste una cadena tresportadora d'electrones formada por una serie de complexos enzimático, ente los que destaquen los citocromos; estos complexos enzimáticos acepten (amenórguense) y vencen (aferrúñense) pares d'electrones d'una manera secuencial, de tal manera que'l primeru dexa electrones al segundu, ésti al terceru, etc., hasta un aceptor final que s'amenorga definitivamente; mientres el so viaxe, los electrones van lliberando enerxía que s'aprovecha pa sintetizar enllaces d'alta enerxía en forma d'ATP.
Otru tipu de reaición redox fundamental nos procesos metabólicos son les deshidrogenaciones, nes cualos una enzima (deshidrogenasa) arrinca un par d'átomos d'hidróxenu a un sustratu; yá que l'átomu d'hidróxenu consta d'un protón y un electrón, dichu sustratu aferrúñase (yá que pierde electrones). Dichos electrones son captaos por molécules especializaes, principalmente les coenzimes NAD+
, NADP+
y FAD qu'al ganar electrones amenórguense, y conducir a les cadenes tresportadores d'electrones antes mentaes.
El metabolismu implica cientos de reaiciones redox. Asina, el catabolismo constituyir reaiciones en que los sustratos aferrúñense y les coenzimes amenórguense. Otra manera, les reaiciones del anabolismo son reaiciones en que los sustratos amenórguense y les coenzimes aferrúñense. Nel so conxuntu, catabolismo y anabolismo constitúin el metabolismu.
Combustión
editarLa combustión ye una reaición química d'amenorgamientu-oxidación, na cual xeneralmente esprender una gran cantidá d'enerxía, en forma de calor y lluz, manifestándose visualmente como fueu.
En toa combustión esiste un elementu qu'ambura (combustible) y otru que produz la combustión (comburente), xeneralmente osíxenu en forma d'O
2 gaseosu. Los esplosivos tienen osíxenu amestáu químicamente, polo que nun precisen l'osíxenu del aire pa realizar la combustión.
Los tipos más frecuentes de combustible son los materiales orgánicos que contienen carbonu y hidróxenu ( ver hidrocarburos). Nuna reaición completa tolos elementos tienen el mayor estáu d'oxidación. Los productos que se formen son el dióxidu de carbonu (CO
2) y l'agua, el dióxidu d'azufre (SO
2) (si'l combustible contién azufre) y pueden apaecer óxidos de nitróxenu (NON
x), dependiendo de la temperatura y la cantidá d'osíxenu na reaición.
Consecuencies
editarNos metales una consecuencia bien importante de la oxidación ye la escomiu, fenómenu d'impautu estructural bien negativu, yá que los materiales adquieren o modifiquen les sos propiedaes según a los axentes que tean espuestos, y como actúen sobre ellos.
Combinando les reaiciones d'oxidación-amenorgamientu (redox) nuna celda galvánica consígense les piles electroquímiques. Estes reaiciones pueden aprovechase pa evitar fenómenos d'escomiu non deseyaos por aciu la téunica del ánodu de sacrificiu y pal llogru de corriente llétrica continua.
Referencies
editar- ↑ Burriel Martí, Fernando; Arribas Jimeno, Siro; Lucena Conde, Felipe; Hernández Méndez, Jesús (2007). Química analítica cualitativa. Editorial Paraninfu, páx. 175. ISBN 9788497321402. Consultáu'l 2 de xunu de 2012. «[...] tamién llamaes reaiciones redox, son aquélles nes que camuda l'estáu o grau d'oxidación de les especies reaccionantes; produzse un intercambiu d'electrones ente los reactivos.»
- ↑ Química pal nuevu mileniu. (Octava edición). Escritu por John William Hill, Doris K Kolb. Páxina 204.
- ↑ Química: la ciencia central. Escritu por Theodore L. Brown,Bruce Y. Bursten, Julia R. Burdge. Páxina 128.
Ver tamién
editarEnllaces esternos
editar- "Videu d'esplicación teórica del conceutu d'oxidación y amenorgamientu" (enllaz rotu disponible n'Internet Archive; ver l'historial y la última versión).
- s'amenorga-y-qu'elementu s'aferruña/ "Exemplu práuticu pa determinar qué especie s'aferruña y qué especie s'amenorga" (enllaz rotu disponible n'Internet Archive; ver l'historial y la última versión).