Capa electrónica
Una capa electrónica,[1] capa d'electrones o cubierta d'electrones puede pensase como'l conxuntu d'órbites siguíes por un grupu d'electrones alredor del nucleu d'un átomu. Cada capa puede contener un ciertu númberu máximu d'electrones, y ta acomuñada con un particular rangu d'enerxía en función de la so distancia al nucleu. Nun átomu estable, por que una cierta capa pueda contener electrones, ye necesariu que toles interiores a ella tean dafechu ocupaes. Los electrones na capa poblada más esterna, llamada capa de valencia y que ye la única que puede atopase parcialmente vacida, determinen les propiedaes químiques del átomu.

Historia
editarLa esistencia de capes d'electrones foi reparada per primer vegada nel rayu X de Charles Barkla y Henry Moseley. Barkla llamar coles lletres K, L, M, N, O, P, y Q. L'orixe d'esta terminoloxía foi alfabéticu. Una capa J foi abarruntada, pero otros esperimentos indicaron que les llinies d'absorción de K yeren producíes pola primer capa d'electrones.
El nome de les capes d'electrones derivar del modelu de Bohr, nel cual pensábase que los grupos d'electrones orbitaban el nucleu a ciertes distancies, asina que les sos órbites formaben capes alredor de los nucleos.
El fisicoquímicu Gilbert Lewis foi responsable del desenvolvimientu tempranu de la teoría de la participación de los electrones de la capa de valencia nos enllaces químicos. Linus Pauling dempués xeneralizo y espandió la teoría al aplicar nociones de la mecánica estructural.
Simboloxía
editarLes capes electróniques son numberaes correlativamente, partiendo de la más cercana al nucleu, ya identifíquense por aciu lletres:
- Capa K, n = 1, ye la más interior, presente en tolos elementos químicos.
- Capa L, n = 2
- Capa M, n = 3
- Capa N, n = 4
- Capa O, n = 5
- Capa P, n = 6
- Capa Q, n = 7
Númberu d'electrones
editarEl númberu máximu d'electrones que puede contener una capa n ye 2n² (hasta la capa N) y de la capa O a la Q va menguando respeutivamente a lo anterior mentáu.
- Númberu d'electrones per capa
(1ª) Capa K hasta 2 electrones (2ª) Capa L hasta 8 electrones (3ª) Capa M hasta 18 electrones (4ª) Capa N hasta 32 electrones (5ª) Capa O hasta 50 electrones (6ª) Capa P hasta 72 electrones (7ª) Capa Q hasta 98 electrones
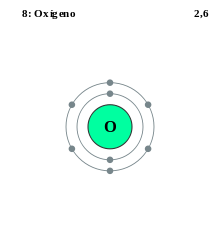
La cantidá de capes d'un átomu depende del so númberu total d'electrones. Los electrones disponer con prioridá na capa más cercana al nucleu hasta qu'ésta s'enche (algámase'l so númberu máximu d'electrones), los electrones restantes asítiase na siguiente capa hasta que ta enchida y asina socesivamente, hasta que yá nun hai electrones. Poro, un átomu d'hidróxenu, que tien un electrón, namái tien una capa , la capa K que ta parcialmente llena (un electrón d'un máximu de dos). Nun átomu d'heliu, que tien dos electrones, dambos distribúyense na capa K que queda dafechu llena (dos electrones d'un máximu de dos). Poro, l'átomu de litiu, que tien tres electrones, tien una capa K enchida (colos dos primeros electrones), y una capa L que contién el tercer electrón.
Dizse qu'una capa ta enchida si contién el so númberu máximu d'electrones. L'hidróxenu ye l'únicu elementu que nun tener el so capa K enchida.
Subcapas
editarCada capa componer d'una o más subcapas, que de la mesma se componen de los orbitales atómicos. Por casu, la primer capa (Plantía:Serif) tien una subcapa, llamada 1s; la segunda capa (Plantía:Serif) tien dos subniveles, llamaos 2s y 2p; la tercer capa (Plantía:Serif) tien 3s, 3p y 3d; la cuarta (Plantía:Serif) tien les subcapas 4s, 4p, 4d y 4f; la quinta capa (Plantía:Serif) tien 5s, 5p, 5d y 5f y teóricamente puede contener más. Los diversos subniveles posibles amosar na siguiente tabla:
| Etiqueta de subcapa |
ℓ | Númberu máx. electrones |
Capes conteniéndolo | Nome históricu |
|---|---|---|---|---|
| Plantía:Serif | 0 | 2 | Cada capa | sharp [‘aguda’] |
| Plantía:Serif | 1 | 6 | 2ª capa y cimeres | principal [‘principal'] |
| Plantía:Serif | 2 | 10 | 3ª capa y cimeres | diffuse [‘difusa’] |
| Plantía:Serif | 3 | 14 | 4ª capa y cimeres | fundamental [‘fundamental'] |
| Plantía:Serif | 4 | 18 | 5ª capa y cimeres (teóricamente) | (la siguiente n'orde alfabéticu dempués de la Plantía:Serif)[2] |
Exemplu
editarEl sodiu tien once electrones. La so estructura electrónica ye la siguiente:(K)2 (L)8 (M)1. Les capes K y L tán enchíes.
El númberu máximu d'electrones dexaos en cada capa nun ye cualesquier. Según el principiu de Pauli, ye igual a 2n² pa la nésima capa. va completar con 2 electrones na capa K, 8 na capa L, 18 na M, etc. En resume:(K)2(L)8(M)18(N)32(O)50(P)72 ...
Esti modelu d'enllenáu de les capes electróniques foi cuestionáu pola física cuántica con un modelu más complexu, pero que paez más próximu a la realidá a escala atómica: amás de les capes, tien de tenese en cuenta la esistencia de subcapas electróniques denominaes s, p, d, f, g, y que tienen los sos propios númberos máximos d'electrones pa tar enchíes.
Les coses complicar dende l'átomu de potasiu (Z = 19): El 19y electrón asítiase na capa de N, ente que la capa M nun ta enchida (puede contener 18 electrones, a pesar de que namái contién 8).
Asina, pal átomu de potasiu, tenemos:(K)2(L)8(M)8(N)1 en llugar de (K)2(L)8(M)9.
Lo mesmo asocede col átomu de calciu (Z = 20), pero pa los átomos con un númberu atómicu ente'l 20 y 30, los 20ésimos a 30ésimos electrones asítiase na capa M, que terminen d'enllenar antes d'enllenar la capa N.
Ver tamién
editarReferencies
editar- ↑ Macy, Rudolph (1 de xineru de 1976). Química orgánica simplificada (en castellanu). Reverte. ISBN 9788429173314. Consultáu'l 15 d'avientu de 2015.
- ↑ Jue, T. (2009). «Quantum Mechanic Basic to Biophysical Methods», Fundamental Concepts in Biophysics (n'inglés). Berlín: Springer, páx. 33. ISBN 1-58829-973-2.
Enllaces esternos
editar
- Wikimedia Commons tien conteníu multimedia tocante a capes electróniques.