Virus
En bioloxía, un virus[n. 1] (del llatín virus, «toxina» o «venenu») ye un axente infeiciosu microscópicu que namás pue multiplicase dientru de les célules d'otros organismos. Los virus infesten tolos tipos d'organismos, dende animales y plantes, hasta bacteries y arques. Los virus son demasiáo pequeños pa ser endilgaos cola sóla ayuda d'un microscopiu ópticu, polo que se diz que son submicroscópicos. El primer virus conocíu, el virus del mosaicu del tabacu,[n. 2] foi afayáu por Martinus Beijerinck en 1899,[1][2] y anguaño describiéronse más de 5.000, magar dellos autores cunten que podríen esistir millones de tipos distintos.[3][4] Los virus topar en casi tolos ecosistemes de la Tierra y son el tipu d'entidá biolóxica más abondosa.[4][5] L'estudiu de los virus recibe'l nome de viroloxía,[6] una caña de la microbioloxía.[7][8]
Virus | ||
|---|---|---|
 | ||
| Clasificación de los virus | ||
| Dominiu: | Nucleacuaea | |
| Reinu: | Virus | |
| Grupos | ||
| Consultes | ||
| [editar datos en Wikidata] | ||
A diferencia de los priones, los virus compónense de dos o trés partes: el so material xenéticu, que porta la información hereditaria, que puede ser ADN o d'ARN; una cubierta proteico que protexe a estos xenes llamada cápside— y en dalgunos tamién puede atopase una bicapa lipídica que los arrodia cuando s'atopen fuera de la célula denomada envoltura vírica—. Los virus varíen na so forma, dende simples helicoides o icosaedros hasta estructures más complexes. L'orixe evolutivu de los virus entá ye inciertu, dalgunos podríen evolucionar a partir de plásmidos (fragmentos d'ADN que se mueven ente les célules), ente qu'otros podríen habese aniciáu dende bacteries. Amás, dende'l puntu de vista de la evolución d'otres especies, los virus son un mediu importante de tresferencia horizontal de xenes, que amonta la diversidá xenética.[9]
Los virus tremar de munches maneres distintes y cada tipu de virus tien un métodu distintu de tresmisión. Ente estos métodos atopen los vectores de tresmisión, que son otros organismos que los tresmiten ente portadores. Los virus vexetales arrobínense frecuentemente por inseutos que s'alimenten del so cazumbre, como los áfidos, ente que los virus animales suélense arrobinar per mediu d'inseutos hematófagos. Per otru llau, otros virus nun precisen de vectores: el virus de la gripe (rinovirus) arrobinar pol aire al traviés de les tusíes y la tos y los norovirus son tresmitíos por vía fecal-oral, o al traviés de les manes, alimentos y agua contaminaos. Los rotavirus estiéndense de cutiu por contautu direutu con neños infestaos. El VIH ye unu de los munchos virus que se tresmiten por contautu sexual o por esposición con sangre infestada.[10]
Non tolos virus provoquen enfermedaes, una y bones munchos virus reproducir ensin causar nengún dañu al organismu infestáu. Dellos virus como'l VIH pueden producir infeiciones permanentes o cróniques cuando'l virus sigue retrucar nel cuerpu safando los mecanismos de defensa del güéspede.[11][12][13] Nos animales, sicasí, ye frecuente que les infeiciones víriques produzan una respuesta inmunitaria que confier una inmunidá permanente a la infeición. Los microorganismos como les bacteries tamién tienen defenses contra les infeiciones víriques, conocíes como sistemes de restricción-cambéu. Los antibióticos nun tienen efeutu sobre los virus, pero desenvolviéronse melecines antivirales pa tratar infeiciones potencialmente mortales.[14]
Etimoloxía
editarLa pallabra provién del llatín virus, que fai referencia al venenu o dalguna sustancia nocivo, y foi usada per primer vegada n'inglés en 1392.[15] Bederre, del llatín virulentus (venenosu), data del 1400.[16] La mención de «axente que causa enfermedaes infeicioses» usar por primer vegada en 1728,[15] enantes del descubrimientu de los virus por Dmitri Ivanovski en 1892. L'axetivu "viral" data de 1948.[17] El términu «virión» tamién s'utiliza pa referise a una única partícula vírica infeiciosa. El plural ye «virus».
Historia
editarA mediaos del sieglu XIX, Louis Pasteur propunxo la teoría xerminal de les enfermedaes, na cual esplicaba que toles enfermedaes yeren causaes y arrobinaes por dalgún tipu de vida diminuta» que se multiplicaba nel organismu enfermu, pasaba d'ésti a otru y facer carecer.[18] Pasteur, sicasí, atopábase trabayando cola hidrofobia, y afayó qu'anque la enfermedá fora contaxosa y ésta se contrayera pol mordigañu d'un animal rabiosu, nun se vía'l xerme per nengún llau. Pasteur concluyó que'l xerme sí s'atopaba ende, pero yera demasiáu pequeñu como pa poder reparase.[19]
En 1884, el microbiólogu francés Charles Chamberland inventó un filtru (conocíu anguaño como filtru Chamberland o filtru Chamberland-Pasteur) que tien poros de tamañu inferior a los d'una bacteria. Con éses podía faer pasar pol filtru una solución con bacteries y esaniciales dafechu de la mesma.[20] El biólogu rusu Dmitri Ivanovski utilizó esti filtru pa estudiar lo qu'anguaño se conoz como virus del mosaicu del tabacu. Los sos esperimentos demostraron que los estractos de fueyes molíes de plantes infestaes de tabacu siguíen siendo infeiciosos dempués de penerar. Ivanovski suxirió que la infeición podría ser causada por una toxina producida poles bacteries, pero nun siguió sofitando esta idea.[21] Naquella dómina pensábase que tolos axentes infeiciosos podíen ser reteníos por filtros y, amás, que podíen ser cultivaos nun mediu con nutrientes —esta opinión formaba parte de la teoría xerminal de les enfermedaes.[1] En 1899, el microbiólogu neerlandés Martinus Beijerinck repitió los esperimentos de Ivanovski y quedó convencíu de que se trataba d'una nueva forma d'axente infeiciosu.[22] Reparó que l'axente namái se multiplicaba dientro de célules vives en división, pero como los sos esperimentos nun amosaben que tuviera compuestu de partícules, llamar contagium vivum fluidum («xerme viviente soluble») y reintrodució el términu «virus».[21] Beijerinck caltenía que los virus yeren de naturaleza líquida, una teoría más tarde refugada por Wendell Stanley, que demostró que yeren particulados.[21] Nesi mesmu añu, en 1899, Friedrich Loeffler y Frosch pasaron l'axente de la fiebre aftosa —el aftovirus— por un filtru similar y refugaron la posibilidá de que se tratara d'una toxina por cuenta de la baxa concentración, y llegaron a la conclusión de que l'axente podía retrucar.[21]
A principios del sieglu XX, el bacteriólogu inglés Frederick Twort afayó los virus qu'infestaben bacteries, qu'anguaño se denominen bacteriófagos,[23] y el microbiólogu francu Félix de Herelle describió virus que, cuando los añader a bacteries cultivaes en agar, producíen zones de bacteries muertes. Esleió con precisión una suspensión d'estos virus y afayó que les diluciones más altes, en llugar de matar toles bacteries, formaben zones discretes d'organismos muertos. Cuntando estes zones, y multiplicándoles pol factor de dilución, De Herelle pudo calcular el númberu de virus en dicha zona.[24]
A finales del sieglu XIX, los virus definir en términos del so infeitividad, filtrabilidad, y la so necesidá de güéspedes vivientes. Los virus namái fueren cultivaos en plantes y animales. En 1906, Ross Granville Harrison inventó un métodu pa cultivar texíos en linfa, y, en 1913, Y. Steinhardt y collaboradores utilizaron esti métodu pa cultivar virus Vaccinia en fragmentos de córnea de cobaya.[25] En 1928, H. B. Maitland y M. C. Maitland cultivaron el mesmu virus en suspensiones de reñones picaos de pita. El so métodu nun foi adoptáu llargamente hasta 1950, cuando s'empezar a cultivar poliovirus a gran escala pa la producción de vacunes.[26]
Otra meyora producir en 1931, cuando'l patólogu estauxunidense Ernest William Goodpasture cultivó'l virus del gripe y otros virus en güevos fertilizaos de pita.[27] En 1949, John Franklin Enders, Thomas Weller y Frederick Robbins cultivaron virus de la polio en célules cultivaes d'embriones humanos, siendo la primer vegada que se cultivó un virus ensin utilizar texíos animales sólidos o güevos. Esti trabayu dexó a Jonas Salk crear una vacuna efeutiva contra la polio.[28]
Cola invención de la microscopía electrónica en 1931 per parte de los inxenieros alemanes Ernst Ruska y Max Knoll, llográronse les primeres imáxenes de virus.[29][30] En 1935, el bioquímicu y virólogu estauxunidense Wendell Stanley esaminó'l virus del mosaicu del tabacu y afayó que taba compuestu principalmente de proteínes.[31] Poco tiempu dempués, el virus foi dixebráu nos sos partes de proteínes y d'ARN.[32] El virus del mosaicu del tabacu foi unu de los primeros en ser cristalizaos, y por tanto, la primer estructura que pudo ser reparada en detalle. Les primeres imáxenes por difracción de rayos X del virus cristalizáu fueron llograes por Bernal y Fankuchen en 1941. Basándose nes sos imáxenes, Rosalind Franklin afayó la estructura completa del virus en 1955.[33] El mesmu añu, Heinz Fraenkel-Conrat y Robley Williams demostraron que'l ARN purificado del virus del mosaicu del tabacu y les sos proteínes d'envoltura pueden reproducise por sigo solos, formando virus funcionales, suxiriendo qu'esti mecanismu senciellu yera probablemente como se reproducíen los virus nes célules güéspedes.[34]
La segunda metá del sieglu XX foi la edá dorada del descubrimientu de virus, y la mayoría de les 2.000 especies reconocíes de virus animales, vexetales y bacterianos fueron afayaes mientres estos años.[35] En 1957, afayáronse'l arterivirus equín y la causa de la foria vírica bovina (un pestivirus). En 1963, el virus de la hepatitis B foi afayáu por Baruch Blumberg,[36] y en 1965, Howard Temin describió'l primera retrovirus. La transcriptasa inversa, enzima clave qu'utilicen los retrovirus pa convertir el so ARN n'ADN, describióse orixinalmente en 1970, de manera independiente por Howard Temin y David Baltimore.[37] En 1983, l'equipu de Luc Montagnier del Institutu Pasteur de Francia aislló per primer vegada'l retrovirus anguaño llamáu VIH.[38]
Orixe
editarLos virus son organismos parásitos qu'infesten célules y producen viriones pa espublizar los sos xenes. La mayoría de les proteínes virales nun tienen homólogos nes célules modernes, en contradicción cola visión tradicional de los virus como los lladrones de xenes celulares». Esto suxer que los xenes virales básicamente tienen el so orixe mientres la replicación de los xenomes virales y/o fueron reclutados de llinaxes celulares agora estinguíos. Dalgunes proteínes virales específiques tán presentes en virus qu'infesten a los miembros de los tres dominios de la vida,[39] lo que suxer que los virus son en realidá bien antiguos. En particular, los analises estructurales de proteínes de la cápside revelaron que siquier dos tipos de viriones aniciar de manera independiente primero que LUCA (el postreru antepasáu universal celular). Anque delles hipótesis fueron apocayá propuestes pa esplicar l'orixe de los virus, l'apaición de viriones, como un mecanismu específicu pal espardimientu de xenes, permanez ensin esplicación.
Les meyores na carauterización de los virus a nivel molecular, suxeren que los virus coevolucionan colos sos organismos güéspedes,[40] por cuenta de que los virus son parásitos intracelulares estremos y, poro, riquen de la sobrevivencia del güéspede pa poder asegurar la so propia sobrevivencia. Ye interesante notar que cuando un virus retrucar nel so güéspede natural, tiende a nun causar enfermedá nel mesmu o causa una enfermedá leve y autolimitada na mayoría de los casos. Dellos de los virus conocíos producen enfermedaes severes namái cuando infesten organismos distintos a los sos güéspedes naturales. Lo anterior suxer que bona parte de los virus acomuñaos cola producción d'enfermedaes, son virus que tán en procesu d'afaese a un nuevu tipu de güéspede y qu'una vegada llograda dicha adautación, la estratexa del virus consiste en perpetuase y arrobinase ensin afectar al organismu güéspede.
Pueden atopase virus uquier qu'haya organismos vivos, y probablemente esisten dende l'apaición de les primeres célules. El so orixe ye inciertu, yá que non fosilicen, de manera que namái puede especulase a partir de distintos téuniques y ensayos de bioloxía molecular.[41][42] Estes téuniques dependen de la disponibilidad d'ADN o ARN víricu antiguu, pero desgraciadamente la mayoría de virus que fueron calteníos y almacenaos en llaboratorios tienen menos de 90 años.[43][44] Hai tres teoríes principales sobre l'orixe de los virus:[45][46]
- Teoría de la regresión: ye posible que los virus fueren pequeñes célules que parasitaban célules más grandes. A lo llargo del tiempu, los xenes que nun precisaben pol so parasitismu sumieron. Les bacteries Rickettsia y Chlamydia son célules vivientes que, como los virus, namái pueden reproducise dientro de célules güéspedes. L'exemplu d'estes bacteries paez sofitar esta teoría, pos ye probable que la so dependencia del parasitismu causara la perda de los xenes que-yos dexaben sobrevivir fora d'una célula. Tamién se-y llama «teoría de la dexeneración».[47][48]
- Teoría del orixe celular (tamién llamada «hipótesis del nomadeo» o «hipótesis del vagabundeo»):[47][49] dellos virus podríen evolucionar a partir de fragmentos d'ADN o ARN que «escaparon» de los xenes d'un organismu mayor. L'ADN fuxitivu podría provenir de plásmidos (fragmentos d'ADN que pueden movese ente célules) o transposones. Estos son molécules d'ADN que se retrucar y muévense a distintes posiciones nel interior de los xenes de la célula.[50] D'antiguo llamaos «xenes saltarinos», son exemplos d'elementos móviles xenéticos y podríen ser l'orixe de dellos virus. Los transposones fueron afayaos en 1950 por Barbara McClintock a partir de los sos estudios en maíz.[51]
- Teoría de la coevolución: los virus podríen evolucionar de complexes molécules de proteínes y acedu nucleico, coles mesmes qu'apaecieron les primeres célules na Tierra, y seríen dependientes de la vida celular mientres munchos millones d'años. Los viroides son molécules de ARN que nun son clasificaes como virus porque escarecen d'envoltura proteica. Sicasí, tienen carauterístiques comunes a diversos virus y de cutiu llámase-yos axentes subvíricos.[52] Los viroides son importantes patóxenos de les plantes.[53] Non codifican proteínes, pero interactúan cola célula güéspede y utilizar pa retrucar y producir les sos proteínes.[54] El virus de la hepatitis D de los humanos tien un xenoma de ARN similar al de los viroides pero tien un envoltoriu proteicu deriváu del virus de la hepatitis B y nun puede producir unu propiu. Poro, ye un virus defectuosu que nun puede retrucar ensin l'ayuda del virus de la hepatitis B.[55] De la mesma forma, el virófago 'sputnik' ye dependiente del mimivirus, que infesta a Acanthamoeba castellanii.[56] Estos virus que dependen d'otres especies víriques reciben el nome de satélites, y podríen representar estadios evolutivos entemedios ente los viroides y los virus.[57][58]
Los priones son molécules proteiques infeicioses que nun contienen nin ADN nin ARN.[59] Nes oveyes, causen una infeición llamada tembladera ovina, y nel ganáu vacuno causen encefalopatía esponxiforme bovina (la enfermedá de les vaques lloques»). Nos humanos, causen kuru y la enfermedá de Creutzfeldt-Jakob.[60] Son capaces de retrucar pos delles proteínes pueden esistir en dos formes distintes y los priones camuden la forma normal d'una proteína güéspede na forma del prion. Esto empecipia una reacción en cadena na que cada proteína priónica convierte munches proteínes del güéspede en más priones, y estos priones converten de la mesma entá más proteínes en priones. Anque son fundamentalmente distintos de los virus y los viroides, el so descubrimientu da credibilidá a la teoría de que los virus podríen evolucionar de molécules autoreplicadoras.[61]
L'analís informáticu de secuencies d'ADN de los virus y los güéspedes ta produciendo una meyor comprensión de les rellaciones evolutives ente distintos virus y podría ayudar a identificar los antepasaos de los virus modernos. Na actualidá, estos analises nun ayudaron a decidir cuál (o cuálos) de les teoríes primeramente afilvanaes ye correuta. Sicasí, paez improbable que tolos virus anguaño conocíos compartan un antepasáu común y probablemente los virus apaecieron en delles ocasiones nel pasáu per mediu d'unu o más mecanismos, colo cual, podríen ser correutes toes elles.[62]
Microbioloxía
editarPropiedad de vida
editarEsisten opiniones desemeyaes sobre si los virus son una forma de vida o estructures orgániques que interactúan colos seres vivos. Por ello dellos autores referir a ellos como «organismos a la llende de la vida».[63] Per una parte aseméyense a los organismos que tienen xenes y evolucionen por seleición natural,[64] y reprodúcense creando múltiples copies de sigo mesmos pa autoensamblarse. Sicasí, escarecen d'estructura celular, lo cual ye consideráu la unidá básica de la vida. Amás, los virus nun tienen un metabolismu propiu, y precisen una célula hospedadora pa crear nuevos productos. Por tanto, nun pueden reproducise nel esterior d'una célula güéspede (anque bacteries como Rickettsia y Chlamydia son consideraos organismos vivos a pesar de tener la mesma llimitación). Les formes de vida aceptaes utilicen la división celular pa reproducise, ente que los virus apaecen de forma súbita y en gran cantidá dientro de les célules, lo que ye análogu a la crecedera autónoma de los cristales. El autoensamblaje de los virus dientro de les célules tien implicaciones pal estudiu del orixe de la vida, pos refuerza les hipótesis de que la vida podría empezar en forma de molécules orgániques autoensamblantes.[65]
Acedu nucleico
editarEl acedu nucleico nos virus contién la información específica y el potencial pa modificar operaciones na célula infestada.[66] Los ácidos nucleicos son macromolécules constituyíes por cadenes de nucleótidos, que de la mesma tán constituyíos por una base nitrogenada asociada a un azucre del grupu de les pentoses y a unu o más grupos de fosfatos. Esisten cuatro posibles tipos d'acedu nucleico viral:[67] ADN de cadena senciella, ADN de cadena doble, ARN de cadena senciella y ARN de cadena doble. Virus que contienen cualesquier d'estos tipos d'acedu nucleico pueden ser atopaos tantu ente los fagos como ente los virus qu'infesten a plantes o animales.[68]
L'ADN de dellos bacteriófagos carauterizar por contener bases rares que substituyen dalguna o dalgunes de les bases de normal presentes nel ADN.[68] L'ADN de cadena doble presente en dellos virus, carauterizar por tener segmentos de cadena senciella en dambos estremos de la molécula. Por cuenta de que son complementaries les secuencies de nucleótidos presentes en dambos estremos. L'ADN naturalmente circular puede ser de cadena senciella como nel fago ØXI74,[68] o de cadena doble, como nel virus SV4O. Esiste evidencia de que dellos virus ARN que producen infeiciones en vexetales como la llimonal y la papa contienen molécules circulares de ARN.
Nos últimos diez años desenvolviéronse una variedá de téuniques y métodos que dexen determinar la secuencia de nucleótidos en cualquier tipu d'acedu nucleico. La primer secuencia completa d'un ARN viral foi determinada nel fago MS2 pol grupu de Walter Fiers en 1976.[68] En 1977, Fred Sanger y collaboradores publicaron la secuencia completa del xenoma del fago ØXl74,[68] constituyíu por ADN de cadena senciella. Darréu, munchos otros xenomes virales de mayor tamañu y complexidá fueron secuenciaos en parte o na so totalidá.
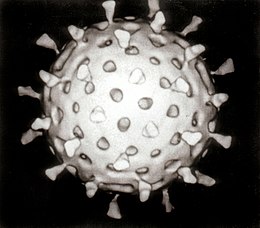
Estructura
editarLos virus presenten una amplia diversidá de formes y tamaños, llamaes «morfoloxíes». Son unes 100 vegaes más pequeños que les bacteries. La mayoría de los virus estudiaos tienen un diámetru d'ente 10 y 300 nanómetros. Dellos Filovirus tienen un tamañu total d'hasta 1.400 nm, sicasí, namái miden unos 80 nm de diámetru.[69] La mayoría de virus nun pueden ser reparaos con un microscopiu ópticu, de manera que s'utilicen microscopios electrónicos de barríu y de tresmisión pa visualizar partícules víriques.[70] P'aumentar el contraste ente los virus y la fonderada utilícense tinciones trupes en electrones. Son soluciones de sales de metales pesaos como wolframiu, qu'esvalixen electrones nes rexones cubiertes pola tinción. Cuando les partícules víriques tán cubiertes pola tinción (tinción positiva), escurecen los detalles finos. La tinción negativa evita esti problema, tiñendo namái la fonderada.[71]
Una partícula vírica completa, conocida como virión, consiste nun acedu nucleico arrodiáu per una capa de proteición proteica llamada cápside. Les cápsides tán compuestes de subunidades proteiques idéntiques llamaes capsómeros.[72] Los virus tienen un «envolvedoriu lipídico» deriváu de la membrana celular del güéspede. La cápside ta formada por proteínes codificadas pol xenoma víricu, y la so forma ye la base de la distinción morfolóxica.[73][74] Les subunidades proteiques codificadas polos virus se autoensamblan pa formar una cápside, xeneralmente precisando la presencia del xenoma viral. Sicasí, los virus complexos codifican proteínes que contribúin a la construcción de la so cápside. Les proteínes acomuñaes colos ácidos nucleicos son conocíes como nucleoproteínes, y l'asociación de proteínes de la cápside vírica con acedos nucleicos víricos recibe'l nome de nucleocápside.[75][76] Polo xeneral, hai cuatro tipos principales de morfoloxía vírica:
- Helicoidal
- les cápsides helicoidales componer d'un únicu tipu de capsómero apilado alredor d'una exa central pa formar una estructura helicoidal que puede tener un cuévanu central o un tubu buecu. Esta formación produz viriones en forma de barra o de filo, pueden ser curtios y bien ríxidos, o llongures y bien flexibles. El material xenético, de normal ARN monocatenario, pero dacuando ADN monocatenario, queda xuníu a la héliz proteica por interacciones ente l'acedu nucleico con carga negativa y la carga positiva de les proteínes. Polo xeneral, el llargor d'una cápside helicoidal ta en rellación col llargor del ácidu nucleico que contién, y el diámetru depende del tamañu y la distribución de los capsómeros. El conocíu virus del mosaicu del tabacu ye un exemplu de virus helicoidal.[77]
- Icosaédrica
- la mayoría de virus qu'infesten los animales son icosaédricos o casi-esféricos con simetría icosaédrica. Un icosaedru regular ye la meyor manera de formar una carcasa zarrada a partir de subunidades idéntiques. El númberu mínimu riquíu de capsómeros idénticos ye dolce, cada unu compuestu de cinco subunidades idéntiques. Munchos virus, como los rotavirus, tienen más de dolce capsómeros y paecen esféricos, calteniendo esta simetría. Los ápices de los capsómeros tán arrodiaos por otros cinco capsómeros y reciben el nome de pentones. Les cares triangulares d'éstos tamién se componen d'otros seis capsómeros y reciben el nome de hexones.[78]
- Envoltura
- delles especies de virus envolubrar nuna forma modificada d'una de les membranes celulares, o bien ye la membrana esterna qu'arrodia una célula güéspede infestada, o bien membranes internes como la membrana nuclear o'l retículo endoplasmático, consiguiendo asina una bicapa lipídica esterior conocida como envoltoriu víricu. Esta membrana rellenar de proteínes codificadas pol xenoma víricu y el del güéspede, la membrana lipídica en sí y tolos carbohidratos presentes son codificados dafechu pol güéspede. El virus del gripe y el VIH utilicen esta estratexa. La mayoría de virus envueltos dependen de la envoltura pa infestar.[79]
- Complexos
- los virus tienen una cápside que nun ye nin puramente helicoidal, nin puramente icosaédrica, y que puede tener estructures adicionales como coles proteiques o una paré esterior complexa. Dalgunos bacteriófagos (como'l Fago T4) tienen una estructura complexa que consiste nun cuerpu icosaédrico xuníu a una cola helicoidal (esta cola actúa como una xeringa molecular, atacando ya inyectando el xenoma del virus a la célula güéspede),[80] que puede tener una base hexagonal con fibres caudales proteiques que sobresalgan.
Los poxvirus son virus grandes y complexos con una morfoloxía inusual. El xenoma víricu ta acomuñáu con proteínes dientro d'una estructura discal central conocida como nucleoide. El nucleoide ta arrodiáu per una membrana y dos cuerpos llaterales de función desconocida. El virus tien una envoltura esterior con una trupa capa de proteína na superficie. La partícula polo xeneral ye llixeramente pleomorfa, con una forma que puede dir de la d'un güevu a la d'un lladriyu.[81] Mimivirus ye'l virus más grande conocíu, con un diámetru nel so cápside de 400 nm. De la so superficie proyéctense filamentu proteicos de 100 nm. La cápside, tomada en microscopiu electrónicu, tien una forma hexagonal, de manera que probablemente ye icosaédrica.[82]
Dellos virus qu'infesten a les Archaees tienen estructures inusuales, que nun tán rellacionaes con nengún otru virus conocíu. Otramiente, dellos bacteriófagos pueden tener distintes estructures tocantes a la so cola, con formes daqué rares con al respective de otros virus.[83]
Xenoma
editar| Propiedad | Parámetro |
|---|---|
| Acedu nucleico |
|
| Forma |
|
| Cadenes |
|
| Sentíu |
|
Puede vese una enorme variedá d'estructures xenómiques ente les especies de virus que, como grupu, contienen una diversidá xenómica cimera a la de los reinos de plantes, los animales o les bacteries. Hai millones de distintos tipos de virus;[3] y namái alredor de 5.000 d'ellos fueron descritos refechamente.[2] Un virus tien un xenoma compuestu d'ADN o bien de ARN, y reciben respeutivamente los nomes de «virus ADN» y «virus ARN». La gran mayoría de virus utilicen el ARN. Los virus de les plantes tienden a tener ARN monocatenario y los bacteriófagos tienden a tener ADN bicatenario.[84]
Los xenomes víricos pueden ser circulares, como los polyomaviridae o lliniales, como los adenoviridae. El tipu d'ácidu nucleico ye irrelevante pa la forma del xenoma. Nos virus ARN, el xenoma de cutiu ta estremáu en partes dixebraes dientro del virión, y califíccase-y de «segmentado». Cada segmentu suel codificar una proteína y los segmentos suelen tar axuntaos nuna cápside. Nun ye necesariu que cada segmentu atopar nel mesmu virión porque'l virus polo xeneral ye infeiciosu, como lo demuestra'l Brome mosaic virus.[69]
Poco importa'l tipu d'acedu nucleico, un xenoma víricu pue ser o bien monocatenario o bicatenario. Los xenomes monocatenarios consisten nun ácidu nucleico non empareyáu, similar a la metá d'una escalera de mano cortada pola metá. Los virus bicatenarios consisten en dos acedos nucleicos empareyaos y complementarios, similares a una escalera de mano entera. Dellos virus, como los Hepadnaviridae, contienen un xenoma que ye parcialmente bicatenario y parcialmente monocatenario.[84]
Nos virus ARN o los virus ADN monocatenarios, les cadenes pueden ser o bien positives (cadenes plus) o negatives (cadenes minus), dependiendo de si son complementaries nel ARN mensaxeru (ARNm) víricu. El ARN viral positivu ye idénticu al ARNm viral y por tanto pue ser traducíu darréu pola célula güéspede. El ARN viral negativu ye complementariu del ARNm y por tanto ten de ser convertíu en ARN positivu por una ARN polimerasa enantes de ser traducíu. La nomenclatura del ADN ye similar a la del ARN, tocantes a la cadena codificadora» del ARNm víricu que-y ye complementaria (-), y la «cadena non codificadora» que ye una copia (+).[84]
El tamañu del xenoma varia enforma ente especies. Los xenomes víricos más pequeños namái codifican cuatro proteínes y pesen unos 106 daltons; los más grandes pesen unos 108 daltons y codifican más d'un centenar de proteínes.[84] Los virus ARN suelen tener xenomes más pequeños que los virus ADN por cuenta de una tasa d'error más alta a la de retrucar, y tienen una llende cimera de tamañu. Percima d'esta llende, los errores na replicación del xenoma faen que'l virus sía inofensivu o inclusive, incompetente. Pa compensar esto, los virus ARN de cutiu empecipien un procesu de segmentación nel que'l xenoma ye dixebráu en molécules más pequeñes, amenorgando asina les posibilidaes d'error. Sicasí, los virus ADN tienen xenomes mayores gracies a la elevada fidelidá de les sos enzimes de replicación.[85]
Los virus sufren cambéu xenéticu por diversos mecanismos. Estos inclúin un procesu llamáu deriva xenética nel que les bases individuales del ADN o'l ARN muten n'otres bases. La mayoría d'estes mutaciones puntuales son imperceptibles pos la proteína que codifica el xen nun camuda, pero entá asina, puede conferir ventayes evolutives como resistencia a les melecines antivíricos.[86] El cambéu antigénico produzse cuando hai un cambéu significativu nel xenoma del virus. Esto asocede como resultáu d'una recombinación xenética. Cuando esto produzse nos virus del gripe, pueden resultar pandemies.[87] Los virus ARN suelen esistir como quasiespecies o n'ensames de virus de la mesma especie pero con secuencies de nucleósidos del xenoma llixeramente distintos. Estos grupos son un oxetivu destacáu pola seleición natural.[88].
Los xenomes segmentados ufierten ventayes evolutives; distintes cepes d'un virus col xenoma segmentado pueden intercambiar y combinar xenes, produciendo virus progenénicos (o descendientes) con carauterístiques úniques. Esto recibe'l nome de sexu vírico».[89]
La recombinación xenética ye'l procesu pol cual una cadena d'ADN ye rota y depués xunida al estremu d'una molécula d'ADN distintu. Esto puédese producir cuando distintos virus infesten les mesmes célules coles mesmes, y estudios de la evolución de los virus demostraron que la recombinación tien un papel bien importante nes especies estudiaes.[90] La recombinación ye común nos virus ARN y ADN.[91][92]
Ciclu de los virus
editar- La adhesión o adsorción ye una unión específica ente proteínes de la cápside vírica y receptores específicos de la superficie celular del güéspede, pero dalgunos bacteriófagos tamién son capaces de xuntase a los flaxelos, vellosidaes (pili) o cápsules presentes na superficie de la bacteria hospedera. Por que esto asoceda la bacteria tien de contener el factor sexual "F" o ciertes colicines (factores de resistencia contra axentes antimicrobianos). Los bacteriófagos filamentosos con ADN de cadena senciella xuntar a les puntes d'estos pili ente que los bacteriófagos esféricos de ARN xuntar a les bandes d'éstos. La especificidá d'unión —proteína y cápside— determinar pola variedá de güéspedes de los virus. Por exemplu, el VIH namás infesta linfocitos T humanos, pos la so proteína de superficie, gp120, puede interactuar cola CD4 y con receptores de la superficie del linfocito T. Esti mecanismu evolucionó pa favorecer los virus que namái pueden infestar célules en que pueden retrucar. L'adhesión al receptor que puede inducir cambeos na proteína de la envoltura viral que resulten na fusión de les membranes viral y celular.
- La penetración sigue a la adhesión;[n. 3] los virus introducir na célula güéspede per aciu endocitosis mediada por receptores o por fusión de membrana. Esto recibe de cutiu el nome de penetración vírica. La infeición de les célules vexetales ye distinta a la de les célules animales. Les plantes tienen una paré celular ríxida fecha de celulosa y los virus namái pueden entrar nes célules cuando se produz un trauma na paré celular.[93] Los virus como'l virus del mosaicu del tabacu tamién pueden movese direutamente a les plantes, ente célules, al traviés de poros llamaos plasmodesmos.[94] Les bacteries, como les de les plantes, tienen una fuerte paré celular que los virus tienen que romper pa infestar la célula. Dellos virus evolucionaron mecanismos pa inyectar el so xenoma a la célula bacteriana mientres la cápside viral permanez nel esterior.[95]
- El réfugu ye'l procesu en que la cápside vírica ye degradada por enzimes virales o del güéspede, lliberando asina'l acedu nucleico del xenoma víricu.
- La replicación implica la síntesis de ARN mensaxeru (ARNm) víricu en tolos virus con traces de ARN positivos, la síntesis de proteínes víriques, l'ensamblaxe de proteínes víriques y la replicación del xenoma viral. El procesu de replicación ye esencial pa caltener la estabilidá de la información xenética contenida nel ADN. Esta replicación utiliza enzimes idéntiques a les arreyaes na replicación del ADN celular y una carauterística común ye la presencia d'estructures circulares temporales a lo menos en delles de dichu proceso.
- Tres el ensamblaxe de partícules víriques, de cutiu produzse un cambéu postraduccional de les proteínes víriques. En virus como'l VIH, esti cambéu (dacuando llamada «maduración»), produzse dempués de que'l virus fuera lliberáu de la célula güéspede.[96] L'ensamblaxe puede producir nueves partícules virales. Los virus pueden autoensamblarse nun procesu similar a la cristalización, una y bones les partícules virales, al igual que los cristales, constitúin estructures que s'atopen nun estáu mínimu d'enerxía llibre. Sicasí, el xenoma viral tamién puede especificar ciertos factores "morfogenéticos" que nun contribúin direutamente a formar la estructura del virión, pero son necesarios pal procesu d'ensamblaxe. El fenómenu de autoensamblaje asocede na formación de diverses estructures biolóxiques.
- Los virus son lliberaos de la célula güéspede por lisis—un procesu que mata la célula españando la so membrana. Los virus envueltos (como'l VIH) son lliberaos de la célula güéspede por xemación. Mientres esti procesu, el virus adquier la so envoltura, que ye una parte modificada de la membrana plasmática del güéspede.
Tipos de virus
editarEl material xenético y el métodu pol cual los virus retrúquense, varien ente los distintos tipos.
- Virus ADN
- La replicación del xenoma de la mayoría de virus ADN producir nel nucleu de la célula. Si la célula tien el receptor fayadizu a la superficie, estos virus entren por fusión cola membrana celular o por endocitosis. La mayoría de virus ADN son dafechu dependientes de la maquinaria de síntesis d'ADN y ARN de la célula güéspede, y la so maquinaria de procesamientu de ARN. El xenoma víricu tien de travesar la membrana nuclear de la célula p'aportar a esta maquinaria.[97][98][99][100]
- Virus ADN bicatenario
- Esti tipu de virus tien el so material xenético compuestu por ADN de doble cadena y retrúcase usando una ADN polimerasa,[98] que ye dependiente del ADN y non del ARN. Esti tipu de virus, polo xeneral, tien d'entrar nel nucleu de la célula güéspede primero que sía capaz de retrucar. Amás, estos virus riquen de les polimerasas de la célula güéspede pa retrucar el xenoma viral y, poro, son altamente dependientes del ciclu celular.[99] Por que pueda realizase la infeición y la producción de proxenie del virus ríquese que la célula tea na fase de replicación, que ye cuando les polimerases de la célula tán actives. El virus puede forzar a la célula a realizar la división celular y de forma crónica esto puede conducir al tresformamientu de la célula y, n'última instancia, producir cáncer.[101][102][100]
- Virus ADN monocatenario
- Esti tipu de virus tien nel so material xenético ADN de cadena senciella y retrúcase usando una ADN polimerasa dependiente del ADN —al igual que'l Virus ADN bicatenario.[102] A diferencies de los virus ADN bicatenarios, éstos tienen un ADN infestante monocatenario (de cadena simple), esto ye, formáu por una única cadena de nucleótidos, en llugar de l'habitual doble héliz. Por que esista la replicación nesti virus, ye necesariu que l'ADN de cadena simple convertir n'ADN de cadena doble nes célules infestaes.[99]
- Virus ARN
- Los virus ARN son únicos porque la so información xenética ta codificada en ARN; esto quier dicir qu'usen el acedu ribonucleico (ARN) como material xenético, o bien que nel so procesu de replicación precisa'l ARN. La replicación suelse producir nel citoplasma. Los virus ARN pueden clasificase nunos cuatro grupos según la so manera de replicación. La polaridá del ARN (si puede ser utilizáu direutamente o non pa producir proteínes) determina en gran midida'l mecanismu de replicación, y si el material xenético ye monocatenario o bicatenario. Los virus ARN utilicen les sos propies ARN retrucares pa crear copies del so xenoma.[103]
- Virus ARN bicatenario
- El virus ARN bicatenario ye virus que tien ARN de cadena doble nel so xenoma. Como la mayoría de los virus ARN, retrucar na citoplasma y nun dependen de les polimerasas de la célules güéspede como lu faen los virus ADN, pos inclúin estes enzimes nel virión.[102] La traducción suel ser monocistrónica, lo que significa que cada unu de los segmentos codifica una sola proteína, a diferencia d'otros virus qu'exhiben una traducción más complexa. Una carauterístiques partícular d'éstos ye la so capacidá pa llevar a cabu la trescripción de los segmentos de ARN bicatenarios so les condiciones apropiaes dientro de la cápside.
- Virus ARN monocatenario positivu
- Los virus ARN monocatenarios positivos tienen acedu ribonucleico (ARN) de cadena senciella de sentíu positivu como material xenético y nun se retrucar usando ADN entemediu. Los virus ARN positivos son idénticos al ARNm viral y polo tanto pueden ser darréu traducíos pola célula güéspede. Anque'l ARN purificado d'un virus positivu puede causar direutamente una infeición, ye menos infeiciosu que'l virus completu. La replicación tien llugar principalmente nel citoplasma y nun ye tan dependiente del ciclu celular como nos virus ADN. Los virus ARN de sentíu positivu tienen xenomes cola mesma polaridá del ARNm y pueden ser emplegaos direutamente pa la síntesis de proteínes usando la maquinaria de traducción de la célula güéspede. Una d'estes proteínes codificadas ye la ARN replicasa, una ARN polimerasa que copia'l ARN viral ensin necesidá de pasar por una cadena d'ADN entemedia.[102]
- Virus ARN monocatenario negativu
- Esti virus tien acedu ribonucleico (ARN) de cadena senciella de sentíu negativu como material xenético y nun se retrucar usando ADN entemediu.[102] El ARN viral negativu ye complementariu del ARNm y polo tanto tien de convertise en ARN positivu por una ARN polimerasa enantes de la traducción. El ARN purificado d'un virus negativu nun ye por sí mesmu infeiciosu yá que precisa ser traducíu en ARN positivu. Los virus ARN de sentíu negativu utilicen una ARN polimerasa o transcriptasa pa formar ARN de sentíu positivu. Esto significa que'l virus tien d'apurrir la enzima ARN polimerasa yá que ésta ye dependiente del ARN. La molécula ARN de sentíu positivu entós actúa como un ARNm viral, que se traduz en proteínes polos ribosomas del güéspede. Les proteína resultante dedícase direutamente a la producción de los elementos de los nuevos viriones, tales como les proteínes de la cápside y la ARN replicasa, que s'encarga de la producción de nueves molécules de ARN de sentíu negativu.
- Virus ARN monocatenario retrotrescritu
- Un virus ARN monocatenario retrotrescritu (o virus ssRNA-RT) ye un virus con ARN de cadena senciella nel so xenoma que se retrucar na célula güéspede per aciu trescripción inversa, esto ye, per aciu la formación d'ADN a partir del molde ARN.[102] Estos virus usen transcriptasa inversa codificada viralmente, esto ye, una ADN polimerasa dependiente del ARN, pa producir ADN a partir del xenoma ARN viral. Esti ADN de cutiu intégrase nel xenoma del güéspede, como nel casu de los retrovirus y seudovirus, onde ye retrucáu y trescritu pol güéspede.
- Virus ADN bicatenario retrotrescritu
- Los virus de trescripción inversa retrucar per aciu la trescripción inversa, que ye la formación d'ADN a partir d'una plantía de ARN.[102] Los virus de trescripción inversa que contienen un xenoma de ARN utilicen un entemediu d'ADN pa retrucar, ente que los que contienen un xenoma d'ADN utilicen un entemediu de ARN mientres la replicación del xenoma.
Efeutos na célula güéspede
editarLa variedá d'efeutos estructurales y bioquímicos de los virus sobre les célules güéspede ye grande.[104] Reciben el nome de «efeutos citopáticos».[105]La mayoría d'infeiciones víriques acaben provocando la muerte de la célula güéspede, ente que les sos causes tán la lisis de la célula, les alteraciones de la membrana superficial de la célula y l'apoptosis.[106] De cutiu, la muerte de la célula ye causada pol paru de les sos actividaes normales por cuenta de la supresión por proteínes específiques del virus, que nun son toes componentes de la partícula vírica.[107]
Dellos virus nun causen cambeos aparentes na célula infestada. Les célules en que los virus ye latente ya inactivu presenten pocos signos d'infeición y de cutiu funcionen de normal.[108] Esto causa infeiciones persistentes y el virus de cutiu permanez durmiente mientres munchos meses o años. Este suel ser el casu del herpes simple.[109][110] Dellos virus, como'l virus de Epstein-Barr, de cutiu faen abondar les célules ensin causar malinidá,[111] pero otros, como los papilomavirus, son una causa demostrada de cáncer.[112]
Clasificación
editarLes clasificaciones intenten describir la diversidá de virus dándo-yos nome y arrexuntándolos según les sos semeyances. En 1962, André Lwoff, Robert Horne y Paul Tournier fueron los primeres en desenvolver una forma de clasificación de los virus, basada nel sistema xerárquicu linneano.[113] Esti sistema basa la clasificación en filos, clases, órdenes, families, xéneros y especies. Los virus fueron arrexuntaos según les sos propiedaes compartíes (non les de los sos güéspedes) y el tipu d'acedu nucleico del que se compón el so xenoma.[114] Darréu formóse Comité Internacional de Taxonomía de Virus.
Clasificación del ICTV
editarEl Comité Internacional de Taxonomía de Virus (ICTV) desenvolvió'l sistema de clasificación actual y escribió pautes que daben más importancia a ciertes propiedaes de los virus pa caltener la uniformidá familiar. Un sistema universal pa clasificar los virus y una taxonomía unificada fueron establecíos dende 1966. El 7 º Informe del ICTV formalizó per primer vegada'l conceutu d'especie vírica como'l taxón más baxu d'una xerarquía ramificada de taxones de virus.[n. 4][115] Sicasí, anguaño namái s'estudió una pequeña parte de tola diversidá de los virus, y analises de muestres llograes d'humanos revelen qu'aproximao un 20% de secuencies víriques recuperaes nun fueron reparaes enantes. Muestres del ambiente, como sedimentos marinos y oceánicos, revelen que la gran mayoría de secuencies son dafechu nueves.[116]
La estructura xeneral de la taxonomía ye la siguiente:
- Orde (-virales)
- Familia (-viridae)
- Subfamilia (-virinae)
- Familia (-viridae)
La taxonomía actual del ICTV (2008) reconoz cinco órdenes: los caudovirales, los herpesvirales, los mononegavirales, los nidovirales y los picornavirales. El comité nun estrema formalmente ente subespecies, cepes y aislamientos. En total, hai cinco órdenes, 82 families, 11 subfamilies, 307 xéneros, 2.083 especies y unos 3.000 tipos qu'entá nun fueron clasificaos.[117][118]
Clasificación Baltimore
editarDavid Baltimore, biólogu ganador del Premiu Nobel, diseñó'l sistema de clasificación que lleva'l so nome.[37][119] El sistema de clasificación del ICTV ye utilizáu en combinación col sistema de clasificación de Baltimore na clasificación moderna de los virus.[120][121][122]
La clasificación de Baltimore de los virus basar nel mecanismu de producción de ARNm. Los virus tienen de xenerar ARNm del so xenoma pa producir proteínes y retrucar, pero cada familia de virus utiliza mecanismos distintos. El xenoma de los virus puede ser monocatenario (ss) o bicatenario (ds), de ARN o ADN, y pueden utilizar o non la transcriptasa inversa. Amás, los virus ARN monocatenarios pueden ser o positivos (+) o negativos (-). Esta clasificación parte los virus en siete grupos:
- I: Virus dsDNA (ej., adenovirus, herpesvirus, poxvirus)
- II: Virus ssDNA (ej., parvovirus)
- III: Virus dsARN (ej., reovirus)
- IV: Virus (+)ssRNA (ej., picornavirus, togavirus)
- V: Virus (-)ssRNA (ej., Ortomixovirus, rabdovirus)
- VI: Virus ssRNA-RT (ej., retrovirus)
- VII: Virus dsDNA-RT (ej., Hepadnaviridae)
Como exemplu de la clasificación vírica, el virus de la varicela, varicela zoster (VZV), pertenez al orde de los herpesvirales, la familia de los Herpesviridae, la subfamilia de los Alphaherpesvirinae y el xéneru Varicellovirus. El VZV atopar nel grupu I de la clasificación de Baltimore porque ye un virus ADN bicatenario que nun utiliza la transcriptasa inversa.
Virus y enfermedaes humanes
editarExemplos d'enfermedaes humanes comunes provocaes por virus inclúin el resfriáu, la gripe, la varicela y el herpes simple.[125][126][127] Munches enfermedaes graves como'l ébola, el sida, la gripe aviar y el SARS son causaes por virus.[128][129][130] La capacidá relativa de los virus de provocar enfermedaes describir en términos de «roxura». Otres enfermedaes tán siendo investigaes p'afayar si'l so axente causante tamién ye un virus, como la posible conexón ente'l herpesvirus humanu 6 (HHV6) y enfermedaes neurolóxiques como la esclerosis múltiple y el síndrome de fatiga crónica.[131] Anguaño esiste un alderique sobre si'l bornaviridae, d'antiguo consideráu la causa d'enfermedad neurolóxiques nos caballos, podría ser la causa d'enfermedaes psiquiátriques nos humanos.[132]
Los virus tienen distintos mecanismos per aciu los cualos causen enfermedaes a un organismu, que dependen en gran midida na especie de virus. Los mecanismos a nivel celular inclúin principalmente la lisis de la célula, esto ye, la rotura y posterior muerte de la célula. Nos organismos pluricelulares, si muerren demasiaes célules del organismu polo xeneral va empezar a sufrir los sos efeutos. Anque los virus causen una disrupción de la homeostasis saludable, provocando una enfermedá, tamién pueden esistir de manera relativamente inofensiva nun organismu. Un exemplu sería la capacidá del virus del herpes simple de permanecer nun tao durmiente dientro del cuerpu humanu. Esto recibe'l nome de «llatencia»[133] y ye una carauterística de tolos herpesvirus, incluyendo'l virus de Epstein-Barr (que causa mononucleosis infeiciosa) y el virus de la varicela zoster (que causa la varicela). Les infeiciones latentes de varicela pueden xenerase darréu na etapa adulta del ser humanu en forma de la enfermedá llamada herpes zóster.[134] Sicasí, estos virus latentes delles vegaes suelen ser beneficiosos, amontando la inmunidá del cuerpu contra dellos seres patóxenos, como ye'l casu del Yersinia pestis.[135] Cuando dalguna enfermedá viral vuelve reincidir en cualquier etapa de la vida conozse popularmente como culebruca.
Dellos virus pueden causar infeiciones permanentes o cróniques, en que los virus siguen retrucar nel cuerpu a pesar de los mecanismos de defensa del güéspede.[136] Esto ye habitual nes infeiciones de virus de la hepatitis B y de la hepatitis C. Los enfermos crónicos son conocíos como portadores, pos sirven de reservorio de los virus infeiciosos.[137] En poblaciones con una proporción elevada de portadores, dizse que la enfermedá ye endémica.[138] Dellos virus pueden mutar dientro de les célules güéspedes, reforzando los sos defenses contra diversos antivirales, procesu conocíu como mutación.[139]
Epidemioloxía
editarLa epidemioloxía viral ye la caña de la ciencia médica qu'estudia la tresmisión y el control d'infeiciones víriques nos humanos. La tresmisión de virus puede ser vertical (de madre a fíu) o horizontal (d'una persona a otra). Exemplos de tresmisión vertical inclúin el virus de la hepatitis B o'l VIH, en que'l ñácaru yá naz infestáu col virus.[140] Otru exemplu más raru ye'l virus de la varicela zóster. De normal causa infeiciones relativamente leves nos humanos, pero puede resultar fatal pa los fetos y los ñácaros naciellos.[141] La tresmisión horizontal ye'l mecanismu d'andada de virus más estendíu. La tresmisión puede ser por intercambiu de sangre o pol cambéu de fluyíos na actividá sexual (ej., VIH, hepatitis B y hepatitis C), pela boca pol intercambiu de cuspia (ej., virus de Epstein-Barr), por alimentos o agua contaminaos (ej., norovirus), pola respiración de virus en forma d'aerosol (ej., virus del gripe) o por inseutos vectores como los mosquitos (ej., dengue). La tasa y la velocidá de la tresmisión d'infeiciones víriques dependen de factores como la densidá de población, el númberu d'individuos susceptibles (los que nun son inmunes),[142] la calidá del sistema sanitariu y el tiempu.[143]
La epidemioloxía utilizar pa romper la cadena d'infeiciones en poblaciones mientres biltos d'enfermedaes víriques.[144] Utilícense midíes de control basándose na conocencia de la manera de tresmisión del virus. Una vegada identificáu'l virus, dacuando puede rompese la cadena d'infeición per mediu de vacunes. Cuando nun puede cuntase con vacunes, pueden resultar eficientes el saneamientu y la desinfeición. De cutiu aísllense les persones infestaes del restu de la comunidá, y los que tuvieron espuestos al virus son puestos en cuarentena.[145] Pa controlar el biltu de fiebre aftosa en bovinos británicos en 2001, sacrificáronse miles de cabeces de ganáu.[146] La mayoría d'infeiciones víriques de los humanos y otros animales tienen un periodu d'incubación mientres el cual la infeición nun causa nengún signu o síntoma.[147] Los periodos d'incubación de les enfermedaes víriques van dende unos varios díes hasta selmanes, pero son conocíos nel casu de munches infeiciones.[148] Tres el periodu d'incubación hai un periodu de comunicabilidad», un tiempu mientres el cual l'individuu o animal infestáu ye contaxosu y puede infestar otra persona o animal.[149] Esti periodu tamién ye conocíu en munches infeiciones, y la conocencia del llargor de dambos periodos ye importante nel control de biltos.[150] Cuando un biltu causa una proporción inusualmente elevada d'infeiciones nuna población, comunidá o rexón, llámase-y epidemia. Si un biltu estender en tol mundu llámase-y pandemia.[151]
Epidemies y pandemies
editarLes poblaciones amerindies fueron afaraes por enfermedaes contaxoses, especialmente la viruela, llevada a América polos colonos europeos. Ye inciertu'l númberu de nativos americanos muertos por enfermedaes estranxeres dempués de la llegada de Colón a América, pero envaloróse que foi'l 70% de la población indíxena. Los estragos causaos por esta enfermedá contribuyeron significativamente a los intentos de los europeos d'estornar o conquistar la población nativa.[152][153][154][155][156][157][158] Una pandemia ye una epidemia global. La pandemia de gripe de 1918, de cutiu llamada gripe español, foi una pandemia de gripe de categoría 5 provocada por un virus del gripe A inusualmente grave y mortal. Les víctimes de cutiu yeren adultos mozos sanos, en contraste cola mayoría de biltos de gripe, qu'afecten predominantemente pacientes nuevos, vieyos o débiles.[159] La pandemia de gripe español duró de 1918 a 1919. Les estimaciones más antigües dicen que mató ente 40 y 50 millones de persones,[160] ente que les más recién suxeren que podría morrer hasta 100 millones de persones, o un 5% de la población mundial en 1918.[161]
La mayoría d'investigadores creen que'l VIH aniciar nel África subsaḥariana mientres el sieglu XX;[162] y anguaño ye una pandemia, con un númberu envaloráu de 38,6 millones d'enfermos en tol mundu.[163] El Programa Conxuntu de les Naciones Xuníes sobre'l VIH/SIDA (UNAIDS) y la Organización Mundial de la Salú (OMS) envaloren que'l sida mató a más de 25 millones de persones desque foi reconocida per primer vegada'l 5 de xunu de 1981, siendo una de les epidemies más destructives de la hestoria.[164] En 2007 hubo 2,7 millones d'infeiciones con VIH y dos muertes rellacionaes con esti virus.[165]
Dellos patóxenos víricos bien letales son miembros de la familia de los Filoviridae. Los Filovirus son virus similares a filamentos que causen la fiebre hemorráxico vírica, ya inclúin el Ébola y los virus de Marburg. El virus de Marburg atraxo l'atención de la prensa n'abril de 2005 por un biltu n'Angola. El biltu, qu'empezó en 2004 y estendióse en 2005, foi la peor epidemia del mundu de cualquier tipu de fiebre hemorráxico vírica.[166]
En 2009, surdió en Méxicu, una supuesta pandemia d'Influenzavirus A (H1N1);[167] conocíu como Virus H1N1/09 Pandémicu.[168] L'orixe de la infeición ye una variante de la cepa H1N1, con material xenético proveniente d'una cepa aviaria, dos cepes porcines y una humana que sufrió una mutación y dio un saltu ente especies (o heterocontagio) de los gochos a los humanos, y arimándose de persona a persona.[169] La pandemia foi clasificada, según la OMS, de Nivel 6. Aproximao, morrieron 14.286 en tol mundu por causa de esta enfermedá.[170]
Cáncer
editarLos virus son una causa establecida de cáncer nos humanos y otres especies. Los cánceres virales son demasiáu raros y namái asoceden d'unes cuantes persones (o animales). Los virus que producen cáncer pueden provenir de munches families, tantu de virus ADN como de virus ARN, y non namái del oncovirus (un términu obsoleto pa referise a los retrovirus). El desenvolvimientu del cáncer puede debese a gran cantidá de factores como la debilidá inmunitaria del güéspede y mutaciones nésti.[171][172] Los virus más importantes acomuñaos con cánceres humanos son el papilomavirus humanu, el virus de la hepatitis B, el virus de Epstein-Barr, y el virus T-linfotrópico humanu. El más recién descubrimientu d'un virus que causa cáncer ye'l poliomavirus (Merkel cell polyomavirus) que ye la causa d'un raru cáncer de piel denomináu carcinoma de célules de Merkel.[173]
Los virus de la hepatitis pueden causar una infeición crónica que provoca cáncer de fégadu.[174][175] La infeición con virus T-linfotrópico humanu puede causar paraparesia espástica tropical y leucemia de linfocitos T del adultu.[176] Los papilomavirus humanos son una causa establecida de cáncer de cérvix, piel, cursu y pene.[177] Dientro de los Herpesviridae, el human herpesvirus 8 causa sarcoma de Kaposi y linfoma de los cuévanos corporales, y el virus de Epstein-Barr causa linfoma de Burkitt, enfermedá de Hodgkin, trestornu linfoproliferativo de los linfocitos B y carcinoma nasofaríngeo.[178] El Merkel cell poliomavirus ta estrechamente rellacionáu col SV40 y colos poliomavirus del mure que fueron usaos como modelos d'animales pa los virus del cáncer dende hai 50 años.[179]
Respuesta inmune del güéspede
editarLa primer llinia de defensa del organismu contra los virus ye'l sistema inmunitariu innatu. Ésti inclúi les célules y otros mecanismos que defenden al organismu de la infeición d'una forma non específica. Esto significa que les célules del sistema innatu reconocen y respuenden a los axentes patóxenos d'una manera xenérica, pero, a diferencia del sistema inmune adaptativu, nun confieren proteición de llarga duración o inmunidá.[180]
El ARN interferente ye una importante defensa innata contra los virus.[181] Munchos virus tienen una estratexa de replicación qu'implica ARN bicatenario (dsRNA). Cuando tales virus infesten a una célula y lliberen la so molécula o molécules de ARN, darréu una proteína complexo denomada dicer xunir al ARN y cortar en cachos más pequeños. Una vía bioquímica denomada complexu RISC actívase y degrada el ARNm viral. Los rotavirus eviten esti mecanismu nun esnudándose dafechu dientro de la célula. El dsRNA genómico sigue protexíu nel interior del nucleu del virión y llibérense los nuevos ARNm producíos al traviés de los poros de la cápside.[182][183]
Cuando'l sistema inmunitariu adaptativu d'un vertebráu atopa un virus, produz anticuerpos específicos que se xunen al virus y facer non infeiciosu, lo que se denomina inmunidá humoral. Dos tipos d'anticuerpos son importantes. El primeru denominar IgM y ye altamente eficaz pa neutralizar los virus, pero namái ye producíu poles célules del sistema inmune mientres unes poques selmanes. El segundu, denomináu IgG, produzse indefinidamente. La presencia d'IgM nel sangre del güéspede utilizar pa determinar una infeición aguda, ente que l'IgG indica una infeición nel pasáu.[184] Los dos tipos d'anticuerpos analícense cuando se lleven a cabu les pruebes d'inmunidá.[185]
Una segunda llinia de defensa de los vertebraos frente a los virus denominar inmunidá celular y consiste nes célules inmunitarias conocíes como linfocitos T. Les célules del organismu constantemente amuesen curtios fragmentos de les sos proteínes na superficie celular. Si un linfocito T reconoz nuna célula un fragmentu sospechosu de ser viral, destrúi dicha célula y de siguío produzse una proliferación de los linfocitos T específicos pa esi virus. Los macrófagos son les célules especialistes na presentación antigénica.[186][187] La producción d'interferón ye un importante mecanismu qu'intervien tamién na defensa.[188]
Non toles infeiciones por virus producen d'esta manera una respuesta inmune proteutora. El VIH safa al sistema inmunolóxicu pol cambéu constante de la secuencia d'aminoácidos de les proteínes na superficie del virión. Estos persistentes virus refuguen el control per aciu el secuestru y bloquéu de la presentación antigénica, resistencia a les citoquines, fuximientu a les actividaes de los lifocitos T, inactivación de l'apoptosis, y el cambéu antigénico.[189] Otros virus, denominaos "virus neurotróficos", arrobinar nel sistema neural, onde'l sistema inmunolóxicu pue ser incapaz de llegar a ellos.
Prevención
editarYá que los virus utilicen la maquinaria d'una célula güéspede pa reproducise y moren nel interior, son difíciles d'esaniciar ensin matar la célula güéspede. Los enfoques médicos más eficientes pa enfrentase a les enfermedaes víriques conocíos hasta agora son les vacunes, qu'ufierten resistencia a la infeición, y los antivirales.
Vacunes
editarLa vacunación ye una forma barato y eficaz pa la prevención de les infeiciones causaes polos virus. Les vacunes utilizáronse pa prevenir les enfermedaes virales dende muncho primero al descubrimientu de los virus. El so usu dio llugar a un dramáticu amenorgamientu de la morbilidad (enfermedá) y mortalidá (muerte) acomuñada a infeiciones virales como poliomielitis, sarampión, paperes y rubéola.[190] La viruela foi erradicada.[191] Na actualidá disponer de vacunes pa prevenir más de trece infeiciones virales nos seres humanos,[192] y delles más s'utilicen pa prevenir infeiciones virales n'animales.[193] El procesu de vacunación basar na idea de que puede llograse inmunidá específica contra una enfermedá,[194] en particular si provócase ésta en condiciones controlaes de manera que l'individuu nun carez los síntomes acomuñaos con dicha enfermedá y el sistema inmune reacciona produciendo un arsenal d'anticuerpos y célules inmunes con capacidá pa destruyir o neutralizar cualesquier otra invasión per parte del mesmu axente infeiciosu, como los linfocitos T; que son los responsables de coordinar la respuesta inmune celular.[195]
Les vacunes pueden consistir en virus vivos atenuaos o en virus muertos, o en namái les proteínes virales (antígenos).[196] Les vacunes vives contienen formes debilitaes del virus que causa la enfermedá. Les vacunes vives pueden ser peligroses cuando s'alministren a les persones inmunodeficientes, yá que nestes persones inclusive'l virus debilitáu puede causar la enfermedá orixinal.[197] Sicasí, la vacuna contra'l virus de la fiebre mariello, llograda d'una cepa atenuada denomada 17D, ye posiblemente una de les vacunes más segures y eficaces fabricaes.
La bioteunoloxía y les téuniques d'inxeniería xenética utilizar pa producir vacunes de subunidades. Estes vacunes usen namái la cápside de proteínes del virus. La vacuna de la hepatitis B ye un exemplu d'esti tipu de vacuna.[198]Les vacunes de subunidades son segures pa pacientes inmunodeficientes, yá que nun pueden causar la enfermedá.[199]
Melecines antivirales
editarEl primer fármacu que se presentó como axente antiviral verdaderamente selectivu y con ésitu foi'l aciclovir;[200] que foi utilizáu como tratamientu profilácticu del herpes xenital y cutaneu, y tamién nel tratamientu de les mancadures causaes pol Herpes zoster.[201] Mientres los últimos venti años, el desenvolvimientu de fármacos antivirales siguió aumentáu rápido, impulsáu pola epidemia del sida. Les melecines antivirales son de cutiu «análogos de nucleósidos» (falsos nucleósidos, los bloques de construcción de los acedos nucleicos) que los virus incorporen a los sos xenomes mientres la replicación. El ciclu de vida del virus entós detiense por cuenta de que les nueves cadenes d'ADN sintetizaes son defectuoses. Esto debe a que los análogos escarecen de los grupos hidroxilos qu'al pie de los átomos de fósforu formen los enllaces de la fuerte «columna vertebral» de la molécula d'ADN. A esto denominar interrupción de la cadena d'ADN.[202] Exemplos d'análogos de nucleósidos son el aciclovir pa tratar el virus del herpes y lamivudina pa les infeiciones de VIH y hepatitis B. Aciclovir ye unu de los fármacos antivirales más antiguos y frecuentemente prescritos.[203]
La hepatitis C ye causada por un virus ARN. Nel 80% de les persones infestaes, la enfermedá ye crónica y ensin tratamientu siguen siendo infeicioses pal restu de les sos vides. Sicasí, agora esiste un tratamientu efeutivu col fármacu ribavirina, un análogu de nucleósido, en combinación con interferón.[204] Anguaño tase desenvolviendo una estratexa similar con lamivudina pal tratamientu de los portadores crónicos d'hepatitis B.[205] Otros fármacos antivirales n'usu tienen como oxetivu distintos etapes del ciclu replicativo viral. El VIH depende d'una enzima proteolítica denomada proteasa VIH-1 pa ser dafechu infeiciosu. Esiste una clase de melecines denominaes inhibidores de la proteasa que fueron diseñaos pa inactivar esta enzima.
El sida, provocáu pol VIH, tien un tratamientu antiviral de zidovudina (azidotimidina o AZT). La zidovudina ye un potente inhibidor de la transcriptasa inversa (RT), enzima esencial nel procesu de replicación del VIH. Sicasí, los sos efeutos nun son duraderos y en dellos casos, éstos son inútiles, yá que el VIH ye un retrovirus y el so xenoma de ARN tien de ser trescritu pola RT pa convertilo nuna molécula d'ADN que constitúi'l provirus. La zidovudina nun tien nengún efeutu sobre'l provirus, yá que namái inhibe la so formación más non la espresión d'ésta nes célules güéspedes. Per otra parte, l'usu duraderu de zidovudina podría provocar una mutación del VIH, faciendo resistente al virus a esti tratamientu.
Infeición n'otres especies
editarLos virus infesten tou tipu de vida celular y, anque los virus esisten en tol mundu, cada especie celular tien un grupu de virus específicu, que de cutiu namái infesten esta especie.[206] Los virus son importantes patóxenos del ganáu. Enfermedaes como la fiebre aftosa y la llingua azul son causaes por virus.[207] Los animales de compañía (como perros, gatos y caballos), si nun se-yos vacuna, son susceptibles a infeiciones víriques graves. El parvovirus canín ye causáu por un pequeñu virus ADN y les infeiciones de cutiu son fatales nos cachorros.[208] Como tolos invertebraos, l'abeya del miel ye susceptible a munches infeiciones víriques.[209] Afortunadamente, la mayoría de virus coesisten de manera inofensiva col so güéspede y nun causen signos o síntomes d'enfermedá.[210]
Plantes
editarHai munchos tipos de virus de les plantes, pero de cutiu namái causen una perda de producción, y nun ye económicamente vidable intentar controlalos. Los virus de les plantes de cutiu son tresmitíos d'una planta a otra por organismos conocíos como vectores. De normal son inseutos, pero tamién se demostró que dalgunos fungos, nemátodos y organismos unicelulares son vectores. Cuando se considera económicu'l control d'infeiciones por fitovirus (nos frutos perennes, por casu), los esfuercios concentrar en matar a los vectores y esaniciar güéspedes alternativos como meruxes.[211] Los fitovirus son inofensivos pa los humanos y demás animales, pos namái pueden reproducise en célules vexetales vives.[212]
Les plantes tienen mecanismos de defensa ellaboraos y eficientes contra los virus. Unu de los más eficientes ye la presencia de los llamaos xenes de resistencia (R). Cada xen R confier resistencia a un virus determináu desencadenando zones alcontraes de muerte celular alredor de la célula infestada, que pueden vese a güeyu en forma de manches grandes. Esto detién la espansión de la infeición.[213] La interferencia del ARN tamién ye una defensa efeutiva nes plantes. Cuando tán infestaes, les plantes de cutiu producen desinfestantes naturales que maten los virus, como'l acedu salicílicu, el óxidu nítricu y molécules reactives d'osíxenu.[214]
Bacteries
editarLos bacteriófagos son un grupu desaxeradamente común y diversu de virus. Por exemplu, los bacteriófagos son la forma más común d'entidá biolóxica nos medios acuáticos; nos océanos hai hasta diez veces más d'estos virus que de bacteries,[215] algamando niveles de 250 millones de bacteriófagos por milímetru cúbicu d'agua marino.[216] Estos virus infesten bacteries específiques xuniéndose a molécules receptores de superficie y entrando na célula. Nun periodu curtiu de tiempu (en dellos casos nunos minutos), les polimerasas bacterianes empiecen a traducir ARN víricu en proteína. Estes proteínes convertir en nuevos viriones dientro de la célula, proteínes collaboradores qu'ayuden a paecese nuevos viriones, o proteínes implicaes na lisis celular. Les enzimes víricos collaboren na destrucción de la membrana celular y, nel casu del fago T4, un pocu más de venti minutos dempués de la inyeición yá pueden lliberar más de 300 fagos.[217]
El mecanismu principal pol que les bacteries defender de los bacteriófagos ye produciendo enzimes que destrúin l'ADN ayenu. Estes enzimes, llamaes endonucleases de restricción, estacen l'ADN víricu que los bacteriófagos introducen nes célules bacterianes.[218] Les bacteries tamién tienen un sistema qu'utiliza secuencies CRISPR pa retener fragmentos del xenoma de virus que s'atoparon nel pasáu, lo que-yos dexa torgar la replicación del virus per aciu una forma d'interferencia del ARN.[219][220] Esti sistema xenéticu apurre a les bacteries una inmunidá adquirida a les infeiciones.
Archaea
editarDellos virus retrúquense dientro d'arquiar, tratar de virus ADN que paecen nun tener rellación con nenguna otra forma de virus y que tienen una variedá de formes inusuales, como botelles, barres con un gabitu o inclusive llárimes. Estos virus fueron estudiaos en mayor detalle nos termófilossobremanera los órdenes Sulfolobales y Thermoproteales.[4][83] La defensa contra estos virus pueden incluyir la interferencia del ARN de secuencies de secuencies repitíes d'ADN del xenoma arqueobacterial que tán rellacionaes colos xenes de los virus.[221][222]
Aplicaciones
editarCiencies de la vida y medicina
editarLos virus son importantes pal estudiu de la bioloxía molecular y celular, pos son sistemes senciellos que pueden utilizase pa manipoliar ya investigar el funcionamientu de les célules.[223] L'estudiu y l'usu de los virus ufiertó información pervalible sobre aspeutos de la bioloxía celular.[224] Por exemplu, los virus resultaron útiles nel estudiu de la xenética y contribuyeron a entender los mecanismos básicos de la xenética molecular, como la replicación del ADN, la trescripción, la maduración del ARN, la traducción, el tresporte de proteínes y la inmunoloxía.
Los xenetistes de cutiu utilicen virus como vectores pa introducir xenes en célules que tán estudiando. Esto ye útil pa faer que la célula produza una sustancia ayeno, o pa estudiar l'efeutu de la introducción d'un nuevu xen nel xenoma. A esti procesu denominar transducción. De manera similar, la viroterapia utiliza virus como vectores pa tratar diverses enfermedaes, pos pueden dirixise específicamente a célules y al ADN. Tien un usu prometedor nel tratamientu del cáncer y na terapia xénica. Científicos del este d'Europa utilizaron la terapia fágica como alternativa a los antibióticos dende va un tiempu, y l'interés por esti enfoque ta creciendo debíu al altu nivel de resistencia a los antibióticos reparáu anguaño en delles bacteries patóxenes.[225]
Materiales científicos y nanoteunoloxía
editarLos enclinos actuales en nanoteunoloxía prometen faer un usu muncho más versátil de los virus. Dende'l puntu de vista d'un científicu de materiales, los virus pueden ser consideraos nanopartículas orgániques. La so superficie porta ferramientes específiques diseñaes pa cruciar les barreres de la célula güéspede. El tamañu y la forma de los virus, según el númberu y la naturaleza de los grupos funcionales de la so superficie, tán definíos con precisión. Poro, los virus son utilizaos davezu en ciencia de materiales como carcases de cambeos de superficie xuníes de forma covalente. Una cualidá particular de los virus ye que pueden ser diseñaos por evolución empobinada. Les téuniques potentes desenvueltes poles ciencies de la vida tán siendo la base d'enfoques d'inxeniería escontra los nanomateriales, abriendo una gran variedá d'usos muncho más allá de la bioloxía y la medicina.[226]
Por cuenta del so tamañu, forma y estructures químiques bien definíes, los virus fueron utilizaos como moldes pa entamar materiales a nanoescala. Exemplos recién inclúin el trabayu fechu nel Naval Research Laboratory de Washington D. C., utilizando partícules del Cowpea mosaic virus (CPMV) p'amplificar señales en sensores basaos en chips d'ADN. Nesti usu, les partícules víriques dixebren les tinciones fluorescentes utilizaes col fin d'evitar la formación de dímeros non fluorescentes qu'actúen como estintores.[227] Otru exemplu ye l'usu del CPMV como nanoplaca de pruebes pa molécules electróniques.[228]
Armes
editarLa capacidá de los virus de causar epidemies devastadoras nes sociedaes humanes llevantó la esmolición de que puedan convertise n'armes biolóxiques. La esmolición aumentó dempués de que se consiguiera recrear el infame virus del gripe español nun llaboratoriu.[229] El virus de la viruela afaró numberoses sociedaes a lo llargo de la historia enantes de ser erradicado. Anguaño namái esiste en dellos llaboratorios seguros en diversos llugares del mundu,[230] pero les medranes de que pueda ser utilizáu como arma nun tán totalmente infundaos;[230] la vacuna de la viruela nun ye segura —mientres los años anteriores al esraizamientu de la viruela, cayó más xente gravemente enfermo como resultáu de la vacunación que pola mesma viruela[231]— y la vacunación pa la viruela yá nun se practica.[232] Por esti motivu, gran parte de la población humana actual casi nun tien resistencia a la viruela.[230]
Notes
editar- ↑ Renato Dulbecco, en 1975, definió a un virus como:
Ente que la pareya investigadora Lluna y Darnell, en 1967, argumentaron la so propia definición:Un virus ye un parásitu intracelular obligatoriu que puede ser consideráu como un bloque de material xenético (yá sía ADN o ARN) capaz de retrucar en forma autónoma, y que ta arrodiáu per una cubierta de proteína y d'acuando tamién por una envoltura membranosa que lu protexe del mediu y sirve como vehículu pa la tresmisión del virus d'una célula a otra.Los virus son entidaes que los sos xenomes son elementos d'ácidu nucleico que se retrucar dientro de les célules vives utilizando pa esti fin la maquinaria sintética de la mesma célula hospedera y provocando la síntesis d'elementos especializaos que pueden tresferir el xenoma viral escontra otres célules.
Citáu en:- Aranda-Anzaldo, A., D. Viza y R. G. Busnel, "Chemical inactivation of human immunodeficiency virus (HIV) in vitro", Journal of Virological Methods 37, páxs. 71-82.
- Cann, A. J., y J. Karn, "Molecular Biology of HIV: new insights into the virus life-cycle." AIDS3 (suppl. 1), 1989, pp. s19-s34.
- ↑ Nel virus del mosaicu del tabacu (VMT), una proteína compuesta por 158 aminoácidos constitúi la subunidad básica a partir de la cual constrúyese la cápside del virus. En dicha proteína cuandoquier la metá de los aminoácidos presentes nel interior de la macromolécula son de tipu hidrofóbicu, ente que na superficie de la mesma hai tan solo cuatro grupos hidrofóbicos nun segmentu constituyíu por 24 residuos d'aminoácidos.
- ↑ El casu meyor estudiáu de la penetración d'un virus na célula hospedera ta representáu pol casu del fago T2. La cola d'esti fago ye contráctil y na so forma estendida consiste de 24 aniellos de subunidades que formen una funda qu'arrodia a un elementu central. Cada aniellu consta de 6 subunidades pequeñes y 6 subunidades mayores. Dempués de la adsorción del fago a la paré celular, asocede una contraición de la cola que resulta nuna fusión de les subunidades pequeñes y grandes pa dar 12 aniellos de 12 subunidades. El nucleu de la cola nun ye contráctil, razón pola cual, ye espulsáu ya impulsáu al traviés de les capes esternes de la bacteria; xenerando asina que la cabeza del fago contráigase y esto resulta na inyeición del ADN viral na célula bacteriana. Esti procesu posiblemente ye facilitáu pola presencia de la enzima lisozima na cola del fago; enzima que ye capaz de dixerir les proteínes de les cubiertes bacterianes; amás d'eso, hai 144 molécules d'adenosina trifosfato (ATP) na funda de la cola del fago; la enerxía pa la contraición d'esta funda provién de la conversión de la ATP en adenosina difosfato (ADP) per mediu d'una reacción hidrolítica que llibera un grupu fosfatu de la ATP.
- ↑ Según la definición espresada en Fields Virology, "una especie de viral ye una clase politética de virus que constitúin un llinaxe replicante y ocupen un nichu ecolóxicu determináu". Una clase "politética" ye aquella en que los miembros tienen diverses propiedaes comunes, anque nun comparten necesariamente una única carauterística definidora. Los miembros d'una especie de virus son definíos colectivamente por un grupu consensuáu de propiedaes. Con éses les especies de virus difieren los taxones víricos más altos, que son clases "universales" y como tales tán definíes por propiedaes que son necesaries pa ser miembru.
Referencies
editar- ↑ 1,0 1,1 Dimmock p. 4
- ↑ 2,0 2,1 Dimmock p. 49
- ↑ 3,0 3,1 Breitbart M, Rohwer F (Xunu de 2005). "Here a virus, there a virus, everywhere the same virus?". Trends Microbiol 13 (6): 278–84. doi:10.1016/j.tim.2005.04.003. PMID 15936660
- ↑ 4,0 4,1 4,2 Lawrence CM, Menon S, Eilers BJ, et al. (Mayu de 2009). "Structural and functional studies of archaeal viruses". J. Biol. Chem. 284 (19): 12599–603. doi:10.1074/jbc.R800078200. PMID 19158076. PMC 2675988
- ↑ Edwards RA, Rohwer F (Xunu 2005). «Viral metagenomics». Nat. Rev. Microbiol. 3 (6): páxs. 504–10. doi:. PMID 15886693.
- ↑ Villarreal, L. P. (2005) Viruses and the Evolution of Life. ASM Press, Washington DC ISBN 1-55581-309-7
- ↑ Fisher, Bruce; Harvey, Richard P.; Champe, Pamela C. (2007). Lippincott's Illustrated Reviews: Microbiology (Lippincott's Illustrated Reviews Series). Hagerstown, MD: Lippincott Williams & Wilkins. ISBN 0-7817-8215-5. páx. 315
- ↑ Fisher, Bruce; Harvey, Richard P.; Champe, Pamela C. (2007). Lippincott's Illustrated Reviews: Microbiology (Lippincott's Illustrated Reviews Series). Hagerstown, MD: Lippincott Williams & Wilkins. ISBN 0-7817-8215-5. páx. 47
- ↑ Canchaya C, Fournous G, Chibani-Chennoufi S, Dillmann ML, Brüssow H (Agostu 2003). «Phage as agents of llateral gene transfer». Curr. Opin. Microbiol. 6 (4): páxs. 417–24. doi:. PMID 12941415.
- ↑ Shors páxs. 49–50
- ↑ Sepkowitz KA (Xunu 2001). «AIDS--the first 20 years». N. Engl. J. Med. 344 (23): páxs. 1764–72. doi:. PMID 11396444.
- ↑ Weiss RA (May 1993). «How does HIV cause AIDS?». Science 260 (5112): páxs. 1273–9. PMID 8493571.
- ↑ Cecil, Russell (1988). Textbook of Medicine. Philadelphia: Saunders, páx. 1523, 1799. ISBN 0721618480.
- ↑ «Medmicro Chapter 52». Archiváu dende l'orixinal, el 2000-08-18. Consultáu'l 21-02-2009.
- ↑ 15,0 15,1 The Online Etymology Dictionary. «Virus». Consultáu'l 12 de xineru de 2010.
- ↑ The Online Etymology Dictionary. «virulent, a.». Consultáu'l 12 de xineru de 2010.
- ↑ The Online Etymology Dictionary. «viral.». Consultáu'l 12 de xineru de 2010.
- ↑ "The History of the Germ Theory," The British Medical Journal vol. 1 non. 1415 (1888), p. 312.
- ↑ Madigan M, Martinko J (editors). (2005). Brock Biology of Microorganisms (11th ed. ed.). Prentice Hall. ISBN 0-13-144329-1.
- ↑ Shors páxs. 76–77
- ↑ 21,0 21,1 21,2 21,3 Collier p. 3
- ↑ Dimmock p.4–5
- ↑ Shors p. 589
- ↑ D'Herelle F (Setiembre de 2007). "On an invisible microbe antagonistic toward dysenteric bacilli": brief note by Mr. F. D'Herelle, presented by Mr. Roux. 1917. Res. Microbiol. 158(7):553–4. Epub 28 de xunetu de 2007. PMID 17855060
- ↑ Steinhardt, Y; Israeli, C; and Lambert, R.A. (1913) "Studies on the cultivation of the virus of vaccinia" J. Inf Dis. 13, 294–300
- ↑ Collier p. 4
- ↑ Goodpasture EW, Woodruff AM, Buddingh GJ (1931). "The cultivation of vaccine and other viruses in the chorioallantoic membrane of chick embryos". Science 74, páxs. 371–372 PMID 17810781
- ↑ Rosen FS (2004). "Isolation of poliovirus—John Enders and the Nobel Prize". New England Journal of Medicine, 351, páxs. 1481–83 PMID 15470207
- ↑ From Nobel Lectures, Physics 1981–1990, (1993) Editor-in-Charge Tore Frängsmyr, Editor Gösta Ekspång, World Scientific Publishing Co., Singapore.
- ↑ Buist JB Vaccinia y variola: a study of their life history Churchill, Londres
- ↑ Stanley WM, Loring HS (1936). "The isolation of crystalline tobacco mosaic virus protein from diseased tomato plants". Science, 83, p.85 PMID 17756690.
- ↑ Stanley WM, Lauffer MA (1939). "Disintegration of tobacco mosaic virus in urea solutions". Science 88, páxs. 345–347 PMID 17788438
- ↑ Creager AN, Morgan GJ (Xunu de 2008). "After the double helix: Rosalind Franklin's research on Tobacco mosaic virus". Isis 99 (2): 239–72. doi:10.1086/588626. PMID 18702397
- ↑ Dimmock p. 12
- ↑ Norrby Y (2008). "Nobel Prizes and the emerging virus concept". Arch. Virol. 153 (6): 1109–23. doi:10.1007/s00705-008-0088-8. PMID 18446425
- ↑ Collier p. 745
- ↑ 37,0 37,1 Temin HM, Baltimore D (1972). "RNA-direuted DNA synthesis and RNA tumor viruses". Adv. Virus Res. 17: 129–86. doi:10.1016/S0065-3527(08)60749-6. PMID 4348509
- ↑ Barré-Sinoussi, F., Chermann, J. C., Rei, F., Nugeyre, M. T., Chamaret, S., Gruest, J., Dauguet, C., Axler-Blin, C., Vezinet-Brun, F., Rouzioux, C., Rozenbaum, W., and Montagnier, L. (1983). "Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS)". Science 220 (4599): 868–871. doi:10.1126/science.6189183. PMID 6189183.
- ↑ Institut de Génétique et Microbiologie (Abril 2006). «The origin of viruses and their possible roles in major evolutionary transitions.». Virus Res. 5 (117): páxs. 5-16. PMID 16476498. http://www.ncbi.nlm.nih.gov/pubmed/16476498.
- ↑ Koonin EV, Senkevich TG, Dolja VV. (Setiembre 2006). «The ancient Virus World and evolution of cells.». PUBMED I: páxs. 29. PMID 16984643. http://www.ncbi.nlm.nih.gov/pubmed/16984643.
- ↑ Iyer LM, Balaji S, Koonin EV, Aravind L (Abril 2006). «Evolutionary genomics of nucleo-cytoplasmic large DNA viruses». Virus Res. 117 (1): páxs. 156–84. doi:. PMID 16494962. http://linkinghub.elsevier.com/retrieve/pii/S0168-1702(06)00028-1.
- ↑ Liu Y, Nickle DC, Shriner D, et al. (2004). "Molecular clock-like evolution of human immunodeficiency virus type 1". Virology. 10;329(1):101–8, PMID 15476878
- ↑ Shores p. 16
- ↑ Collier páxs. 18-19
- ↑ Shores páxs. 14-16
- ↑ Collier páxs. 11-21
- ↑ 47,0 47,1 Dimmock p. 16
- ↑ Collier, Balows y Sussman p. 11
- ↑ Collier páxs. 11–12
- ↑ Shors p. 574
- ↑ McClintock, B. (Xunu 1950). «[http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pmcentrez&artid=1063197 The origin and behavior of mutable loci in maize]». Proc Natl Acad Sci U S A. 36 (6): páxs. 344–55. doi:. PMID 15430309.
- ↑ Dimmock p. 55
- ↑ Shors 551–3
- ↑ Tsagris EM, d'Alba AE, Gozmanova M, Kalantidis K (Setiembre 2008). «Viroids». Cell. Microbiol. 10 (11): páxs. 2168. doi:. PMID 18764915. Archivado del original el 2022-11-27. https://web.archive.org/web/20221127165054/http://www.blackwell-synergy.com/doi/abs/10.1111/j.1462-5822.2008.01231.x. Consultáu'l 2012-05-16.
- ↑ Shors p. 492–3
- ↑ La Scola B, Desnues C, Pagnier I, Robert C, Barrassi L, Fournous G, Merchat M, Suzan-Monti M, Forterre P, Koonin Y, Raoult D (Setiembre 2008). «The virophage as a unique parasite of the giant mimivirus». Nature 455 (7209): páxs. 100–4. doi:. PMID 18690211.
- ↑ Collier p. 777
- ↑ Dimmock páxs. 55–7
- ↑ Liberski PP (2008). «Prion diseases: a riddle wrapped in a mystery inside an enigma». Folia Neuropathol 46 (2): páxs. 93–116. PMID 18587704. http://www.folianeuro.termedia.pl/showarticle.php?id=10625.
- ↑ Dimmock páxs. 57–58
- ↑ Lupi O, Dadalti P, Cruz Y, Goodheart C (2007). «Did the first virus self-assemble from self-replicating prion proteins and RNA?». Med. Hypotheses 69 (4): páxs. 724–30. doi:. PMID 17512677. http://linkinghub.elsevier.com/retrieve/pii/S0306-9877(07)00261-7.
- ↑ Dimmock páxs. 15–16
- ↑ Rybicki EP (1990) "The classification of organisms at the edge of life, or problems with virus systematics." S Aft J Sci 86:182–186
- ↑ Holmes EC (Ochobre 2007). «Viral evolution in the genomic age». PLoS Biol. 5 (10): páxs. y278. doi:. PMID 17914905. PMC 1994994. http://biology.plosjournals.org/perlserv/?request=get-document&doi=10.1371/journal.pbio.0050278.
- ↑ Koonin EV, Senkevich TG, Dolja VV (2006). «The ancient Virus World and evolution of cells». Biol. Direct 1: p. 29 páxs. 29. doi:. PMID 16984643. PMC 1594570. Archivado del original el 2012-12-04. https://archive.today/20121204144019/http://www.biology-direct.com/content/1//29. Consultáu'l 2020-03-11.
- ↑ Keith Roberts, Martin Raff, Bruce Alberts, Peter Walter, Julian Lewis and Alexander Johnson, Molecular Biology of the Cell 4th Edition, Routledge, March, 2002, hardcover, 1616 pages, 7.6 pounds, ISBN 0-8153-3218-1
- ↑ ARANDA ANZALDO, Armando. La estructura de los virus. 1ro.. p. 6-7. http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/071/htm/sec_6.htm. Consultáu'l 26 de xunu de 2010.
- ↑ 68,0 68,1 68,2 68,3 68,4 Calendar, R., The Bacteriophages, Dos volúmenes, (comp), Plenum Press, 1988.
- ↑ 69,0 69,1 Collier páxs. 33–55
- ↑ Collier páxs. 33–37
- ↑ Kiselev NA, Sherman MB, Tsuprun VL (1990). «Negative staining of proteins». Electron Microsc. Rev. 3 (1): páxs. 43–72. doi:. PMID 1715774.
- ↑ Collier p. 40
- ↑ Caspar DL, Klug A (1962). «Physical principles in the construction of regular viruses». Cold Spring Harb. Symp. Quant. Biol. 27: páxs. 1–24. PMID 14019094.
- ↑ Crick FH, Watson JD (1956). «Structure of small viruses». Nature 177 (4506): páxs. 473–5. doi:. PMID 13309339.
- ↑ Falvo, M.R.; S. Washburn, R. Superfine, M. Finch, F.P. Brooks Jr, V. Chi, R.M. Taylor 2nd (Marzu de 1997). «Manipulation of individual viruses: friction and mechanical properties». Biophysical Journal 72 (3): páxs. 1396–1403. doi:. PMID 9138585. PMC 1184522. http://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B94RW-4V9K7FD-1D&_user=108429&_rdoc=1&_fmt=&_orig=search&_sort=d&view=c&_acct=C000059713&_version=1&_urlVersion=0&_userid=108429&md5=d5aafeb39c5a05782d0935dc7ced27ad.
- ↑ Kuznetsov, Yu. G.; A. J. Malkin, R. W. Lucas, M. Plomp, A. McPherson (1 de setiembre de 2001). «Imaging of viruses by atomic force microscopy». J Xen Virol 82 (9): páxs. 2025–2034. http://vir.sgmjournals.org.
- ↑ Collier p. 37
- ↑ Collier páxs. 40, 42
- ↑ Collier páxs. 42–43
- ↑ Rossmann MG, Mesyanzhinov VV, Arisaka F, Leiman PG (Abril 2004). «The bacteriophage T4 DNA injection machine». Curr. Opin. Struct. Biol. 14 (2): páxs. 171–80. doi:. PMID 15093831.
- ↑ Long GW, Nobel J, Murphy FA, Herrmann KL, Lourie B (Setiembre 1970). «Experience with electron microscopy in the differential diagnosis of smallpox». Appl Microbiol 20 (3): páxs. 497–504. PMID 4322005.
- ↑ Suzan-Monti M, La Scola B, Raoult D (2006). «Genomic and evolutionary aspects of Mimivirus». Virus Research 117 (1): páxs. 145–155. doi:. PMID 16181700.
- ↑ 83,0 83,1 Prangishvili D, Forterre P, Garrett RA (2006). «Viruses of the Archaea: a unifying view». Nat. Rev. Microbiol. 4 (11): páxs. 837–48. doi:. PMID 17041631.
- ↑ 84,0 84,1 84,2 84,3 Collier páxs. 96–99
- ↑ Pressing J, Reanney DC (1984). "Divided genomes and intrinsic noise". J Mol Evol. 20(2):135–46.
- ↑ Pan XP, Li LJ, Du WB, Li MW, Cao HC, Sheng JF (Noviembre 2007). «Differences of YMDD mutational patterns, precore/core promoter mutations, serum HBV DNA levels in lamivudine-resistant hepatitis B genotypes B and C». J. Viral Hepat. 14 (11): páxs. 767–74. doi:. PMID 17927612. http://www.blackwell-synergy.com/openurl?genre=article&sid=nlm:pubmed&issn=1352-0504&fecha=2007&volume=14&númberu=11&spage=767.
- ↑ Hampson AW, Mackenzie JS (Noviembre 2006). «The influenza viruses». Med. J. Aust. 185 (10 Suppl): páxs. S39–43. PMID 17115950. http://www.mja.com.au/public/issues/185_10_201106/ham10884_fm.html.
- ↑ Metzner KJ (Avientu 2006). «Detection and significance of minority quasispecies of drug-resistant HIV-1». J HIV Ther 11 (4): páxs. 74–81. PMID 17578210.
- ↑ Goudsmit, Jaap. Viral Sex. Oxford Univ Press, 1998.ISBN 978-0-19-512496-5 ISBN 0-19-512496-0
- ↑ Worobey M, Holmes EC (1999). «Evolutionary aspects of recombination in RNA viruses». J. Xen. Virol. 80 ( Pt 10): páxs. 2535–43. PMID 10573145.
- ↑ Lukashev AN (2005). «Role of recombination in evolution of enteroviruses». Rev. Med. Virol. 15 (3): páxs. 157–67. doi:. PMID 15578739.
- ↑ Umene K (1999). «Mechanism and application of genetic recombination in herpesviruses». Rev. Med. Virol. 9 (3): páxs. 171–82. doi:. PMID 10479778.
- ↑ Dimmock p. 70
- ↑ Boevink P, Oparka KJ (Agostu 2005). «Virus-host interactions during movement processes». Plant Physiol. 138 (4): páxs. 1815–21. doi:. PMID 16172094. PMC 1183373. http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=16172094.
- ↑ Dimmock p. 71
- ↑ Barman S, Ali A, Hui EK, Adhikary L, Nayak DP (2001). «Transport of viral proteins to the apical membranes and interaction of matrix protein with glycoproteins in the assembly of influenza viruses». Virus Res. 77 (1): páxs. 61–9. doi:. PMID 11451488.
- ↑ Shors p. 54; Collier p. 78
- ↑ 98,0 98,1 N.J. Dimmock, A.J. Easton y K. Leppard, Introduction to Modern Virology, Ed. Wiley, 2006, ISBN 978-1-4051-3645-7.
- ↑ 100,0 100,1 Robertson MP, Igel H, Baertsch R, Haussler D, Ares M Jr, Scott WG (2005). «The structure of a rigorously conserved RNA element within the SARS virus genome». PLoS Biol 3 (1): páxs. y5. PMID 15630477 doi 10.1371/journal.pbio.0030005.
- ↑ John Carter y Venetia Saunders, Virology: Principles and Applications, Ed. Wiley, 2007, ISBN 978-0-470-02387-7.
- ↑ 102,0 102,1 102,2 102,3 102,4 102,5 102,6 A. Kornberg y T.A Baker, DNA Replication, Ed. University Science Books, 2005, ISBN 978-1-891389-44-3.
- ↑ Collier p. 79
- ↑ Collier páxs. 115–146
- ↑ Collier p. 115
- ↑ Roulston A, Marcellus RC, Branton PE (1999). «[http://arjournals.annualreviews.org/doi/abs/10.1146/annurev.micro.53.1.577?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dncbi.nlm.nih.gov Viruses and apoptosis]». Annu. Rev. Microbiol. 53: p. 577–628. doi:. PMID 10547702. http://arjournals.annualreviews.org/doi/abs/10.1146/annurev.micro.53.1.577?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dncbi.nlm.nih.gov.
- ↑ Alwine JC (2008). «Modulation of host cell stress responses by human cytomegalovirus». Curr. Top. Microbiol. Immunol. 325: páxs. 263–79. doi:. PMID 18637511.
- ↑ Sinclair J (Marzu 2008). «Human cytomegalovirus: Latency and reactivation in the myeloid lineage». J. Clin. Virol. 41 (3): páxs. 180–5. doi:. PMID 18164651. http://linkinghub.elsevier.com/retrieve/pii/S1386-6532(07)00434-9.
- ↑ Jordan MC, Jordan GW, Stevens JG, Miller G (Xunu 1984). «Latent herpesviruses of humans». Ann. Intern. Med. 100 (6): páxs. 866–80. PMID 6326635.
- ↑ Sissons JG, Bain M, Wills MR (Febreru 2002). «Latency and reactivation of human cytomegalovirus». J. Infect. 44 (2): páxs. 73–7. doi:. PMID 12076064. http://linkinghub.elsevier.com/retrieve/pii/S016344530190948X.
- ↑ Barozzi P, Potenza L, Riva G, Vallerini D, Quadrelli C, Bosco R, Forghieri F, Torelli G, Luppi M (Avientu 2007). «B cells and herpesviruses: a model of lymphoproliferation». Autoimmun Rev 7 (2): páxs. 132–6. doi:. PMID 18035323. http://linkinghub.elsevier.com/retrieve/pii/S1568-9972(07)00061-4.
- ↑ Subramanya D, Grivas PD (Noviembre 2008). «HPV and cervical cancer: updates on an established relationship». Postgrad Med 120 (4): páxs. 7–13. doi:. PMID 19020360.
- ↑ Lwoff A, Horne RW, Tournier P (1962). «A virus system» (en francés). C. R. Hebd. Seances Acad. Sci. 254: páxs. 4225–7. PMID 14467544.
- ↑ Lwoff A, Horne R, Tournier P (1962). «A system of viruses». Cold Spring Harb. Symp. Quant. Biol. 27: páxs. 51–5. PMID 13931895.
- ↑ Fields p. 27
- ↑ Delwart EL títulu=Viral metagenomics (2007). Rev. Med. Virol. 17 (2): páxs. 115–31. doi:. PMID 17295196.
- ↑ Virus Taxonomy 2008. International Committee on Taxonomy of Viruses. Consultáu'l 15 de setiembre de 2008.
- ↑ ICTV Master Species List 2008 Archiváu 2009-06-16 en Wayback Machine
- Archivu con reportes. Producíu pol Comité Internacional sobre Taxonomía de Virus. Consultáu'l 15 de setiembre de 2008
- ↑ Baltimore D (1974). «The strategy of RNA viruses». Harvey Lect. 70 Series: páxs. 57–74. PMID 4377923.
- ↑ van Regenmortel MH, Mahy BW (2004). «Emerging issues in virus taxonomy». Emerging Infect. Dis. 10 (1): páxs. 8–13. PMID 15078590.
- ↑ Mayu MA (1999). «Developments in plant virus taxonomy since the publication of the 6th ICTV Report. International Committee on Taxonomy of Viruses». Arch. Virol. 144 (8): páxs. 1659–66. doi:. PMID 10486120.
- ↑ de Villiers EM, Fauquet C, Broker TR, Bernard HU, zur Hausen H (2004). «Classification of papillomaviruses». Virology 324 (1): páxs. 17–27. doi:. PMID 15183049.
- ↑ Mainly Chapter 33 (Disease summaries), páxs. 367–392 en:Fisher, Bruce; Harvey, Richard P.; Champe, Pamela C. (2007). Lippincott's Illustrated Reviews: Microbiology (Lippincott's Illustrated Reviews Series). Hagerstwon, MD: Lippincott Williams & Wilkins, páx. páxs. 367–392. ISBN 0-7817-8215-5.|alt=A photograph of the upper body of a man labelled with the names of viruses that infect the different parts
- ↑ For common cold: National Institute of Allergy and Infectious Diseases (NIAID) > Common Cold. Últimu cambéu 10 d'avientu de 2007. Consultáu'l 4 d'abril 2009
- ↑ Thiel V (editor). (2007). Coronaviruses: Molecular and Cellular Biology, 1st, Caister Academic Press. [[:Especial:BookSources/978-1-904455-16-5]|ISBN 978-1-904455-16-5]]].
- ↑ Akhtar, Jihan. «Viral entry mechanisms: cellular and viral mediators of herpes simplex virus entry». FEBS Journal 2009 (276). http://www3.interscience.wiley.com/cgi-bin/fulltext/122668866/PDFSTART.
- ↑ Kawaoka Y (editor). (2006). Influenza Virology: Current Topics. Caister Academic Press. ISBN 978-1-904455-06-6.
- ↑ Smith DK, Grohskopf LA, Black RJ, et al. (2005). «Antiretroviral Postexposure Prophylaxis After Sexual, Injection-Drug Use, or Other Nonoccupational Exposure to HIV in the United States». MMWR 54 (RR02): páxs. 1–20. http://www.cdc.gov/mmwr/preview/mmwrhtml/rr5402a1.htm#tab1.
- ↑ Thacker Y, Janke B (February 2008). «Swine influenza virus: zoonotic potential and vaccination strategies for the control of avian and swine influenzas». The Journal of Infectious Diseases 197 Suppl 1: p. S19–24. doi:. PMID 18269323.
- ↑ Klenk, Hans-Dieter; Feldmann, Heinz (2004). Ebola and Marburg Viruses, Molecular and Cellular Biology, Wymondham, Norfolk: Horizon Bioscience. ISBN 0-9545232-3-7.
- ↑ Komaroff AL títulu=Is human herpesvirus-6 a trigger for chronic aballe syndrome? (Avientu 2006). «Archived copy». J. Clin. Virol. 37 Suppl 1: p. S39–46. doi:. PMID 17276367. Archivado del original el 2009-04-28. https://web.archive.org/web/20090428174804/http://www.hhv-6foundation.org/hhv6cfs_komaroff.html. Consultáu'l 2012-05-16.
- ↑ Chen C, Chiu Y, Wei F, Koong F, Liu H, Shaw C, Hwu H, Hsiao K (1999). «High seroprevalence of Borna virus infection in schizophrenic patients, family members and mental health workers in Taiwan». Mol Psychiatry 4 (1): páxs. 33–8. doi:. PMID 10089006.
- ↑ Margolis TP, Elfman FL, Leib D, et al. (Ochobre 2007). «Spontaneous reactivation of herpes simplex virus type 1 in latently infected murine sensory ganglia». J. Virol. 81 (20): páxs. 11069–74. doi:. PMID 17686862. PMC 2045564. http://jvi.asm.org/cgi/pmidlookup?view=long&pmid=17686862.
- ↑ Whitley RJ, Roizman B (Mayu 2001). «Herpes simplex virus infections». Lancet 357 (9267): páxs. 1513–8. doi:. PMID 11377626.
- ↑ Barton YE, White DW, Cathelyn JS, et al. (Mayu 2007). «Herpesvirus latency confers symbiotic protection from bacterial infection». Nature 447 (7142): páxs. 326–9. doi:. PMID 17507983.
- ↑ Bertoletti A, Gehring A (2007). «Immune response and tolerance during chronic hepatitis B virus infection». Hepatol. Res. 37 Suppl 3: páxs. S331–8. doi:. PMID 17931183.
- ↑ Rodrigues C, Deshmukh M, Jacob T, Nukala R, Menon S, Mehta A (2001). «Significance of HBV DNA by PCR over serological markers of HBV in acute and chronic patients». Indian journal of medical microbiology 19 (3): páxs. 141–4. PMID 17664817.
- ↑ Nguyen VT, McLaws ML, Dore GJ (2007). «Highly endemic hepatitis B infection in rural Vietnam». Journal of Gastroenterology and Hepatology 22 (12): p. 2093 páxs. 2093–100. doi:. PMID 17645465.
- ↑ Witzany G (2006) "Natural Genome-Editing Competences of Viruses'" Acta Biotheor 54: 235–253.
- ↑ Fowler MG, Lampe MA, Jamieson DJ, Kourtis AP, Rogers MF (2007). «Reducing the risk of mother-to-child human immunodeficiency virus transmission: past successes, current progress and challenges, and future direutions». Am. J. Obstet. Gynecol. 197 (3 Suppl): páxs. S3–9. doi:. PMID 17825648.
- ↑ Sauerbrei A, Wutzler P (2000). «The congenital varicella syndrome». Journal of perinatology : official journal of the California Perinatal Association 20 (8 Pt 1): páxs. 548–54. PMID 11190597.
- ↑ Garnett GP (Febreru 2005). «Role of herd immunity in determining the effect of vaccines against sexually transmitted disease». J. Infect. Dis. 191 Suppl 1: páxs. S97–106. doi:. PMID 15627236. http://www.journals.uchicago.edu/cgi-bin/resolve?JID31548.
- ↑ Platonov AE (2006). «(The influence of weather conditions on the epidemiology of vector-borne diseases by the example of West Nile fever in Russia)» (en rusu). Vestn. Akad. Med. Nauk SSSR (2): páxs. 25–9. PMID 16544901.
- ↑ Shors p. 198
- ↑ Shors páxs. 199, 209
- ↑ Shors p. 19
- ↑ Shors p. 126
- ↑ Shors páxs. 193–194
- ↑ Shors páxs. 193–94
- ↑ Shors p. 194
- ↑ Shors páxs. 192–193
- ↑ Ranlet P (2000). «The British, the Indians, and smallpox: what actually happened at Fort Pitt in 1763?». Pa Hist 67 (3): páxs. 427–41. PMID 17216901.
- ↑ Van Rijn K (2006). «"Lo! The poor Indian!" colonial responses to the 1862–63 smallpox epidemic in British Columbia and Vancouver Island». Can Bull Med Hist 23 (2): páxs. 541–60. PMID 17214129.
- ↑ Patterson KB, Runge T (Abril 2002). «Smallpox and the Native American». Am. J. Med. Sci. 323 (4): páxs. 216–22. doi:. PMID 12003378.
- ↑ Sessa R, Palagiano C, Scifoni MG, di Pietro M, Del Pianu M (Marzu 1999). «The major epidemic infections: a gift from the Old World to the New?». Panminerva Med 41 (1): páxs. 78–84. PMID 10230264.
- ↑ Bianchine PJ, Russo TA (1992). «The role of epidemic infectious diseases in the discovery of America». Allergy Proc 13 (5): páxs. 225–32. doi:. PMID 1483570. http://openurl.ingenta.com/content/nlm?genre=article&issn=1088-5412&volume=13&númberu=5&spage=225&aulast=Bianchine.
- ↑ Hauptman LM (Noviembre 1979). «Smallpox and American Indian; Depopulation in Colonial New York». N Y State J Med 79 (12): páxs. 1945–9. PMID 390434.
- ↑ Fortuine R (1988). «Smallpox decimates the Tlingit (1787)». Alaska Med 30 (3): p. 109 páxs. 109. PMID 3041871.
- ↑ Collier páxs. 409–415
- ↑ Patterson KD, Pyle GF (Spring 1991). «The geography and mortality of the 1918 influenza pandemic». Bull Hist Med. 65 (1): páxs. 4–21. PMID 2021692.
- ↑ Johnson NP, Mueller J (2002). «Updating the accounts: global mortality of the 1918–1920 "Spanish" influenza pandemic». Bull Hist Med 76 (1): páxs. 105–15. doi:. PMID 11875246. http://muse.jhu.edu/cgi-bin/resolve_openurl.cgi?issn=0007-5140&volume=76&númberu=1&spage=105&aulast=Johnson.
- ↑ Gao F, Bailles Y, Robertson DL, et al. (1999). «Origin of HIV-1 in the Chimpanzee Pan troglodytes troglodytes». Nature 397 (6718): páxs. 436–441. doi:. PMID doi [//dx.doi.org/10.1038/17130 10.1038/17130 9989410 doi 10.1038/17130].
- ↑ Shors p. 447
- ↑ Mawar N, Saha S, Pandit A, Mahajan O (Avientu 2005). «[http://www.icmr.nic.in/ijmr/2005/december/1201.pdf The third phase of HIV pandemic: social consequences of HIV/AIDS stigma & discrimination & future needs]». Indian J. Med. Res. 122 (6): páxs. 471–84. PMID 16517997. http://www.icmr.nic.in/ijmr/2005/december/1201.pdf.
- ↑ «Status of the global HIV epidemic». UNAIDS. Consultáu'l 15 de setiembre de 2008.
- ↑ Towner JS, Khristova ML, Sealy TK, et al. (Julio 2006). «[http://jvi.asm.org/cgi/pmidlookup?view=long&pmid=16775337 Marburgvirus genomics and association with a large hemorrhagic fever outbreak in Angola]». J. Virol. 80 (13): páxs. 6497–516. doi:. PMID 16775337. PMC 1488971. http://jvi.asm.org/cgi/pmidlookup?view=long&pmid=16775337.
- ↑ «Brotes de gripe en Méxicu y nos Estaos Xuníos». OMS/WHO. Archiváu dende l'orixinal, el 2013-05-08. Consultáu'l 26 d'abril de 2009. «La OMS emite la so opinión en cuanto al biltu de gripe porcín del 2009.»
- ↑ «Press Release: A/H1N1 influenza like human illness in Mexico and the USA: OIE statement». World Organisation for Animal Health (29 d'abril de 2009). Consultáu'l 29 d'abril de 2009.
- ↑ «OMS: Gripe porcín tien potencial pandémicu». RFI (25 d'abril de 2009). Consultáu'l 26 d'abril de 2009.
- ↑ «Reporte diariu del ECDC sobre la pandemia de influenza A (H1N1) de 2009» (inglés). Centru Européu pa la Prevención y Control d'Enfermedad (18-01-2010 09:00 UTC +2).
- ↑ Einstein MH, Schiller JT, Viscidi RP, Strickler HD, Coursaget P, Tan T, Halsey N, Jenkins D (Xunu 2009). «Clinician's guide to human papillomavirus immunology: knowns and unknowns». The Lancet Infectious Diseases 9 (6): páxs. 347–56. doi:. PMID 19467474.
- ↑ Shuda M, Feng H, Kwun HJ, Rosen ST, Gjoerup O, Moore PS, Chang Y (Ochobre 2008). «T antigen mutations are a human tumor-specific signature for Merkel cell polyomavirus». Proceedings of the National Academy of Sciences of the United States of America 105 (42): páxs. 16272–7. doi:. PMID 18812503.
- ↑ Pulitzer MP, Amin BD, Busam KJ (Mayu 2009). «Merkel cell carcinoma: review». Advances in Anatomic Pathology 16 (3): páxs. 135–44. doi:. PMID 19395876.
- ↑ Koike K (2007). «Hepatitis C virus contributes to hepatocarcinogenesis by modulating metabolic and intracellular signalling pathways». J. Gastroenterol. Hepatol. 22 Suppl 1: páxs. S108–11. doi:. PMID 17567457.
- ↑ Hu J, Ludgate L (2007). «HIV-HBV and HIV-HCV coinfection and liver cancer development». Cancer Treat. Res. 133: páxs. 241–52. doi:. PMID 17672044.
- ↑ Bellon M, Nicot C (2007). «Telomerase: a crucial player in HTLV-I-induced human T-cell leukemia». Cancer genomics & proteomics 4 (1): páxs. 21–5. PMID 17726237.
- ↑ Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S (2007). «Human papillomavirus and cervical cancer». Lancet 370 (9590): páxs. 890–907. doi:. PMID 17826171.
- ↑ Klein Y, Kis LL, Klein G (2007). «Epstein-Barr virus infection in humans: from harmless to life endangering virus-lymphocyte interactions». Oncogene 26 (9): páxs. 1297–305. doi:. PMID 17322915.
- ↑ zur Hausen H (Julio 2008). «Novel human polyomaviruses—re-emergence of a well known virus family as possible human carcinogens». International Journal of Cancer. Journal International Du Cancer 123 (2): páxs. 247–50. doi:. PMID 18449881.
- ↑ Alberts, Bruce; Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walters (2002). Molecular Biology of the Cell; Fourth Edition. New York and London: Garland Science. ISBN 0-8153-3218-1.
- ↑ Ding SW, Voinnet O. Antiviral immunity direuted by small RNAs. Cell. 2007 Aug 10;130(3):413-26.
- ↑ Patton JT, Vasquez-Del Carpio R, Spencer Y (2004). «Replication and transcription of the rotavirus genome». Curr. Pharm. Des. 10 (30): páxs. 3769–77. doi:. PMID 15579070.
- ↑ Jayaram H, Estes MK, Prasad BV (2004). «Emerging themes in rotavirus cell entry, genome organization, transcription and replication». Virus Res. 101 (1): páxs. 67–81. doi:. PMID 15010218.
- ↑ Greer S, Alexander GJ. Viral serology and detection. Baillieres Clin Gastroenterol. 1995 Dec;9(4):689-721
- ↑ Laurence JC. Hepatitis A and B immunizations of individuals infected with humanimmunodeficiency virus.Am J Med. 2005 Oct;118 Suppl 10A:75S-83S.
- ↑ Cascalho M, Platt JL. Novel functions of B cells.Crit Rev Immunol. 2007;27(2):141-51.
- ↑ Khatri M, Sharma JM. Modulation of macrophages by infectious bursal disease virus.Cytogenet Genome Res. 2007;117(1-4):388-93
- ↑ -y Page C, Genin P, Baines MG, Hiscott J. Interferon activation and innate immunity.Rev Immunogenet. 2000;2(3):374-86.
- ↑ Hilleman MR. Strategies and mechanisms for host and pathogen survival in acute and persistent viral infections. Proc Natl Acad Sci U S A. 2004 Oct 5;101 Suppl 2:14560-6. Epub 2004 Aug 5.
- ↑ Asaria P, MacMahon Y (2006). «Measles in the United Kingdom: can we eradicate it by 2010?». BMJ 333 (7574): páxs. 890–5. doi:. PMID 17068034.
- ↑ Lane JM (2006). «Mass vaccination and surveillance/containment in the eradication of smallpox». Curr. Top. Microbiol. Immunol. 304: p. 17–29. PMID 16989262.
- ↑ Arvin AM, Greenberg HB (2006). «New viral vaccines». Virology 344 (1): páxs. 240–9. doi:. PMID 16364754.
- ↑ Pastoret PP, Schudel AA, Lombard M (2007). «Conclusions--future trends in veterinary vaccinology». Rev. - Off. Int. Epizoot. 26 (2): páxs. 489–94, 495–501, 503–9. PMID 17892169.
- ↑ Mayer, Gene (2006). «Immunology - Chapter One: Innate (non-specific) Immunity». Microbiology and Immunology On-Line Textbook. USC School of Medicine. Consultáu'l 1 de xineru de 2007.
- ↑ Litman G, Cannon J, Dishaw L (2005). «Reconstructing immune phylogeny: new perspectives.». Nat Rev Immunol 5 (11): páxs. 866-79. PMID 16261174.
- ↑ Palese P (2006). «Making better influenza virus vaccines?». Emerging Infect. Dis. 12 (1): páxs. 61–5. PMID 16494719.
- ↑ Thomssen R (1975). «Live attenuated versus killed virus vaccines». Monographs in allergy 9: p. 155–76. PMID 1090805.
- ↑ McLean AA (1986). «Development of vaccines against hepatitis A and hepatitis B». Rev. Infect. Dis. 8 (4): páxs. 591–8. PMID 3018891.
- ↑ Casswall TH, Fischler B (2005). «Vaccination of the immunocompromised child». Expert review of vaccines 4 (5): páxs. 725–38. doi:. PMID 16221073.
- ↑ «A history of de Discovery and Clinical Application of Antiviral». British Medical Bulletin (41): páxs. 309-314. 1985. http://bmb.oxfordjournals.org/cgi/content/abstract/41/4/309.
- ↑ Irwin, MR., Olmstead, R., Oxman, MN. (2007). Augmenting Immune Responses to Varicella Zoster Virus in Older Adults: A Randomized, Controlled Trial of Tai Chi. Archiváu 2018-12-30 en Wayback Machine J Am Geriatr Soc 55 (4): 511-517. ISSN 1532-5415. Últimu accesu'l 6 de setiembre de 2007. N'inglés.
- ↑ Magden J, Kääriäinen L, Ahola T (2005). «Inhibitors of virus replication: recent developments and prospects». Appl. Microbiol. Biotechnol. 66 (6): páxs. 612–21. doi:. PMID 15592828.
- ↑ Mindel A, Sutherland S (1983). «Xenital herpes - the disease and its treatment including intravenous acyclovir». J. Antimicrob. Chemother. 12 Suppl B: p. 51–9. PMID 6355051.
- ↑ Witthoft T, Moller B, Wiedmann KH, Mauss S, Link R, Lohmeyer J, Lafrenz M,Gelbmann CM, Huppe D, Niederau C, Alshuth O. Safety, tolerability and efficacy of peginterferon alpha-2a and ribavirin in chronic hepatitis C in clinical practice: The German Open Safety Trial. J Viral Hepat. 2007 Nov;14(11):788-96.
- ↑ Rudin D, Shah SM, Kiss A, Wetz RV, Sottile VM. Interferon and lamivudine vs. interferon for hepatitis B y antigen-positive hepatitis B treatment: meta-analysis of randomized controlled trials.Liver Int. 2007 Nov;27(9):1185-93.
- ↑ Dimmock p. 3
- ↑ Bernard La Scola, Christelle Desnues, Isabelle Pagnier, Catherine Robert, Lina Barrassi, Ghislain Fournous, Michèle Merchat, Marie Suzan-Monti, Patrick Forterre, Eugene Koonin and Didier Raoult (2008). «The virophage as a unique parasite of the giant mimivirus». Nature 454 (7205): páxs. 100. doi:.
- ↑ Goris N, Vandenbussche F, De Clercq K (Abril 2008). «Potential of antiviral therapy and prophylaxis for controlling RNA viral infections of livestock». Antiviral Res. 78 (1): páxs. 170–8. doi:. PMID 18035428. http://linkinghub.elsevier.com/retrieve/pii/S0166-3542(07)00435-4.
- ↑ Carmichael L (2005). «An annotated historical account of canine parvovirus». J. Vet. Med. B Infect. Dis. Vet. Public Health 52 (7–8): páxs. 303–11. doi:. PMID 16316389.
- ↑ Chen YP, Zhao Y, Hammond J, Hsu H, Evans JD, Feldlaufer MF (Ochobre–Noviembre de 2004). «Multiple virus infections in the honey bee and genome divergence of honey bee viruses». Journal of Invertebrate Pathology 87 (2–3): páxs. 84–93. doi:. PMID 15579317.
- ↑ Shors p. 584
- ↑ Shors páxs. 562–587
- ↑ Dinesh-Kumar SP, Wai-Hong Tham, Baker BJ (2000). "Structure—function analysis of the tobacco mosaic virus resistance gene N". PNAS 97, 14789-94 PMID 11121079
- ↑ Soosaar JL, Burch-Smith TM, Dinesh-Kumar SP (2005). "Mechanisms of plant resistance to viruses". Nat. Rev. Microbiol. 3, páxs. 789–98 PMID 16132037
- ↑ Wommack KE, Colwell RR (Marzu 2000). «Virioplankton: viruses in aquatic ecosystems». Microbiol. Mol. Biol. Rev. 64 (1): páxs. 69–114. doi:. PMID 10704475. PMC 98987. http://mmbr.asm.org/cgi/pmidlookup?view=long&pmid=10704475.
- ↑ Bergh O, Børsheim KY, Bratbak G, Heldal M (Agostu 1989). «High abundance of viruses found in aquatic environments». Nature 340 (6233): páxs. 467–8. doi:. PMID 2755508.
- ↑ Shors páxs. 595–97
- ↑ Bickle TA, Krüger DH (1 de xunu de 1993). «Biology of DNA restriction». Microbiol. Rev. 57 (2): páxs. 434–50. PMID 8336674. PMC 372918. http://mmbr.asm.org/cgi/pmidlookup?view=long&pmid=8336674.
- ↑ Barrangou R, Fremaux C, Deveau H, et al. (Marzu 2007). «CRISPR provides acquired resistance against viruses in prokaryotes». Science 315 (5819): páxs. 1709–12. doi:. PMID 17379808.
- ↑ Brouns SJ, Jore MM, Lundgren M, et al. (Agostu 2008). «Small CRISPR RNAs guide antiviral defense in prokaryotes». Science 321 (5891): páxs. 960–4. doi:. PMID 18703739.
- ↑ Mojica FJ, Díez-Villaseñor C, García-Martínez J, Soria Y (2005). «Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements». J. Mol. Evol. 60 (2): páxs. 174–82. doi:. PMID 15791728.
- ↑ Makarova KS, Grishin NV, Shabalina SA, Wolf YI, Koonin EV (2006). «A putative RNA-interference-based immune system in prokaryotes: computational analysis of the predicted enzymatic machinery, functional analogies with eukaryotic RNAi, and hypothetical mechanisms of action». Biol. Direct 1: p. 7 páxs. 7. doi:. PMID 16545108. PMC 1462988. Archivado del original el 2013-05-10. https://web.archive.org/web/20130510130945/http://www.biology-direct.com/content/1/1/7. Consultáu'l 2020-03-11.
- ↑ Collier p.8
- ↑ Lodish, Harvey; Berk, Arnold; Zipursky, S. Lawrence; Matsudaira, Paul; Baltimore, David; Darnell, James.Viruses:Structure, Function, and Uses Consultáu'l 16 de setiembre de 2008
- ↑ Matsuzaki S, Rashel M, Uchiyama J, et al. (2005). «Bacteriophage therapy: a revitalized therapy against bacterial infectious diseases». J. Infect. Chemother. 11 (5): páxs. 211–9. doi:. PMID 16258815.
- ↑ Fischlechner M, Donath Y, M (2007). «Viruses as Building Blocks for Materials and Devices». Angewandte Chemie International Edition 46 (18): p. 3184 páxs. 3184–93. doi:. PMID 17348058.
- ↑ Sotu CM, Blum AS, Vora GJ, et al. (Abril 2006). «Fluorescent signal amplification of carbocyanine dyes using engineered viral nanoparticles». J. Am. Chem. Soc. 128 (15): páxs. 5184–9. doi:. PMID 16608355.
- ↑ Blum AS, Sotu CM, Wilson CD, et al. (2005). "An Engineered Virus as a Scaffold for Three-Dimensional Self-Assembly on the Nanoscale". Small, 7, 702.
- ↑ Shors p. 331
- ↑ 230,0 230,1 230,2 Artenstein AW, Grabenstein JD (Ochobre 2008). «Smallpox vaccines for biodefense: need and feasibility». Expert Review of Vaccines 7 (8): páxs. 1225–37. doi:. PMID 18844596. http://www.future-drugs.com/doi/abs/10.1586/14760584.7.8.1225?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%3dncbi.nlm.nih.gov.
- ↑ Aragón TJ, Ulrich S, Fernyak S, Rutherford GW (2003). «Risks of serious complications and death from smallpox vaccination: a systematic review of the United States experience, 1963–1968». BMC public health 3: p. 26 páxs. 26. doi:. PMID 12911836.
- ↑ Weiss MM, Weiss PD, Mathisen G, Guze P (2004). «Rethinking smallpox». Clin. Infect. Dis. 39 (11): páxs. 1668–73. doi:. PMID 15578369.
Bibliografía
editar- Collier, Leslie; Balows, Albert; Sussman, Max (1998) Topley and Wilson's Microbiology and Microbial Infections ninth edition, Volume 1, Virology, volume editors: Mahy, Brian and Collier, Leslie. Arnold. ISBN 0-340-66316-2.
- Dimmock, N.J; Easton, Andrew J; Leppard, Keith (2007) Introduction to Modern Virology sixth edition, Blackwell Publishing, ISBN 1-4051-3645-6.
- Knipe, David M; Howley, Peter M; Griffin, Diane Y; Lamb, Robert A; Martin, Malcolm A; Roizman, Bernard; Straus Stephen Y. (2007) Fields Virology, Lippincott Williams & Wilkins. ISBN 0-7817-6060-7.
- Shors, Teri (2008). Understanding Viruses. Jones and Bartlett Publishers. ISBN 0-7637-2932-9.
Enllaces esternos
editar| Wikispecies tien un artículu sobre Virus. |